
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
Непредельные одноатомные спирты.
Непредельные спирты могут иметь в своей молекуле двойные и тройные связи. Гидроксильная группа не может быть у углерода, связанного с другим углеродом кратной связью. Такие спирты неустойчивы и в момент образования изомеризуются в альдегиды и кетоны (см. кето-енольная таутомерия).
В случае наиболее часто встречающихся непредельных спиртов чаще всего используется тривиальная или рациональная номенклатура. В более сложных случаях применяется систематическая номенклатура. При этом надо иметь в виду, что гидроксил как функциональная группа старше других. Вот некоторые непредельные спирты и их названия:

Рассмотрим важнейшие непредельные спирты.
Первым членом гомологического ряда этиленовых спиртов должен был бы быть виниловый спирт, однако в свободном виде он не существует. Любопытно, что его производные известны и находят применение в технике. Это относится к алкил- и ацилвиниловым эфирам, которые получаются присоединением спиртов и карбоновых кислот к ацетилену (см. химические свойства алкинов). Известен также поливиниловый спирт. Его получают полимеризацией винилацетата с последующим гидролизом полиэфира:
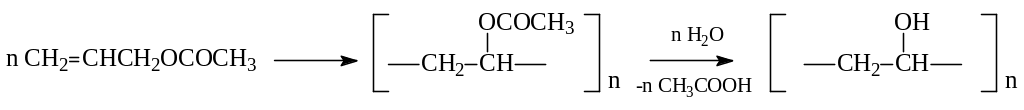
Аллиловый спирт обычно получается гидролизом аллилхлорида. Служит промежуточным продуктом при синтезе глицерина. Аллиловый спирт сочетает в себе свойства спиртов и непредельных углеводородов.
Самым простым представителем ацетиленовых спиртов является пропаргиловый спирт. Пропинол получается конденсацией ацетилена с формальдегидом. Проявляет все свойства спиртов и алкинов:
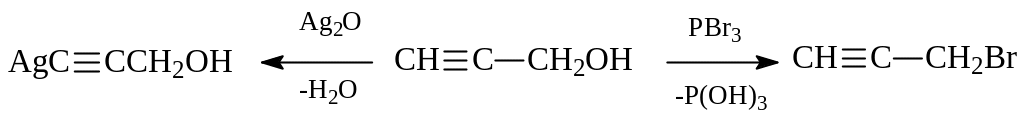
Пропаргиловый спирт может быть использован при получении аллилового спирта и глицерина, бутиндиола и дивинила из него. Гидрированием бутиндиола получают 1,4-бутандиол, а дегидратацией последнего – тетрагидрофуран.
ПРОСТЫЕ ЭФИРЫ.
К простым эфирам относят соединения в молекуле которых кислород связан с двумя одинаковыми или различными углеводородными остатками. Общая формула простых эфиров R-O-R и R-O-R*.
Изомерия, номенклатура. Изомерия и номенклатура простых эфиров обусловлены характером углеводородных радикалов. Свое название эфиры получают либо по названиям радикалов, либо по систематической номенклатуре. В последнем случае меньший радикал вместе с кислородом рассматривается как замещающая группа:
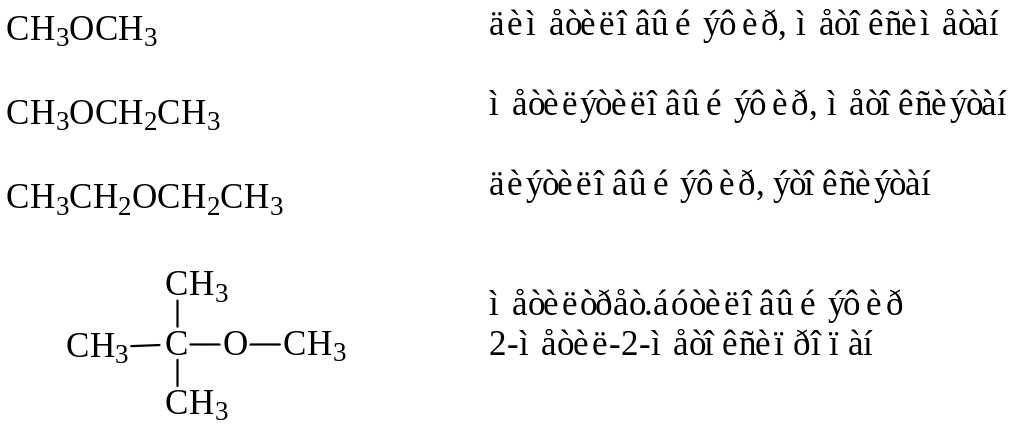
Способы получения. Простые эфиры получают по уже рассмотренным нами реакциям. Это либо нуклеофильное замещение в галогенпроизводных с участием алкоголятов спиртов (реакция Вильямсона), либо межмолекулярная дегидратация спиртов. Реакция Вильямсона позволяет получить симметричные и несимметричные эфиры.
Однако указанные способы получения эфиров оказались малопригодными для промышленного синтеза. Поэтому были разработаны и другие методы. Так, метилтрет.бутиловый эфир, широко используемый в качестве высокооктановой добавки к бензинам, получается в результате реакции присоединения метилового спирта к изобутилену в кислой среде. Эта реакция аналогична гидратации алкенов: вначале происходит протонирование алкена с последующей нуклеофильной атакой молекулой спирта образовавшегося карбокатиона:

Химические свойства. Простые эфиры в качестве функциональной группы содержат кислородный атом с неподеленной парой электронов. Этот класс соединений не может вступить в знакомые уже реакции замещения, присоединения и т.д. Связь С-О в эфирах достаточно прочна и ее трудно разрушить под действием оснований, окислителей и восстановителей. В целом эфиры относятся к мало активным соединениям и практически единственным направлением их превращений является расщепление кислотами.
Известно, что концентрированная серная кислота расщепляет эфирную связь уже на холоду. При этом получаются алкил- и диалкилсульфаты:

Концентрированная иодистоводородная кислота также способна расщеплять эфирную связь. При этом из несимметричных эфиров при повышенных температурах образуются иодистые алкилы. Предполагается, что вначале получается иодистый алкил и спирт, который реагирует с НI и также превращается в галогеналкан:
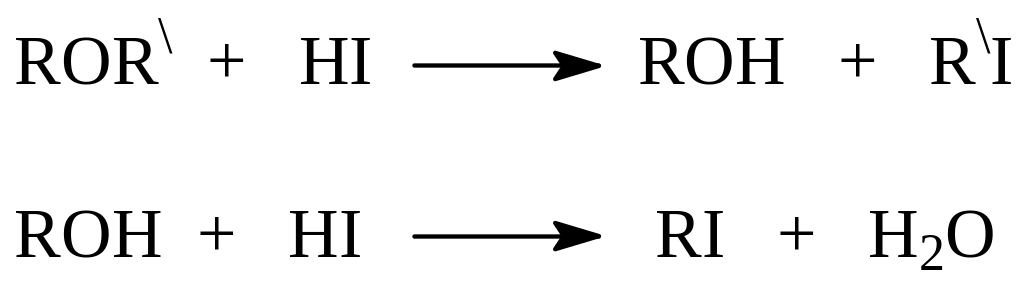
Действительно, в мягких условиях образуется только одно галогенпроизводное и спирт. В этой связи возникает вопрос о порядке разрыва эфирной связи под действием НI.
Давно уже было установлено, что направление расщепления зависит от природы эфира. Метилалкиловые эфиры с первичными и вторичными алкилами превращаются в иодистый метил и соответствующие спирты, а в случае третичных алкилов образуется метиловый спирт и соответствующие третичные иодпроизводные:
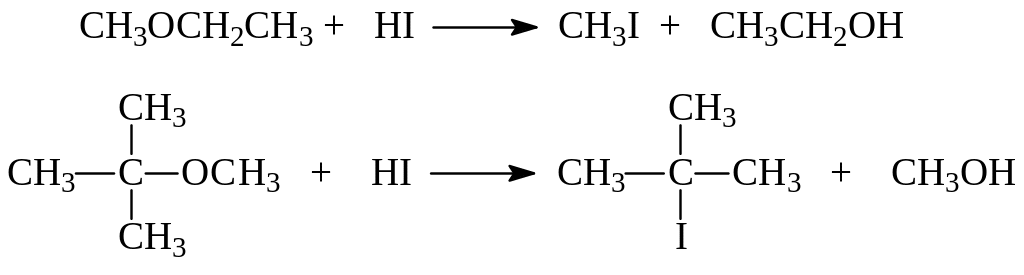
При взаимодействии простых эфиров с иодистоводородной кислотой происходит протонирование эфирного кислорода. В последующем имеет место нуклеофильное замещение. Если одним из радикалов в эфире является третичный алкил – реализуется SN1 – механизм:
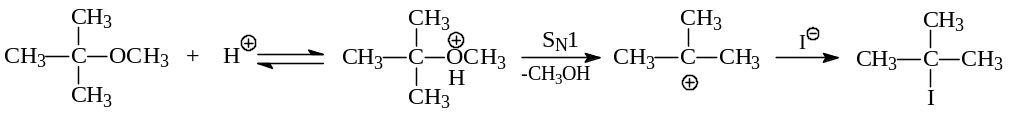
В других случаях реакция идет, по-видимому, по механизму SN2. Причем, уходящей группой оказывается больший алкильный радикал вместе с гидроксильной группой.
Благодаря неподеленным парам электронов на кислородном атоме простые эфиры проявляют слабо выраженные основные свойства и при действии сильных кислот превращаются в неустойчивые оксониевые соли:
![]()
С кислотами Льюиса простые эфиры дают относительно устойчивые координационные комплексы. Например,

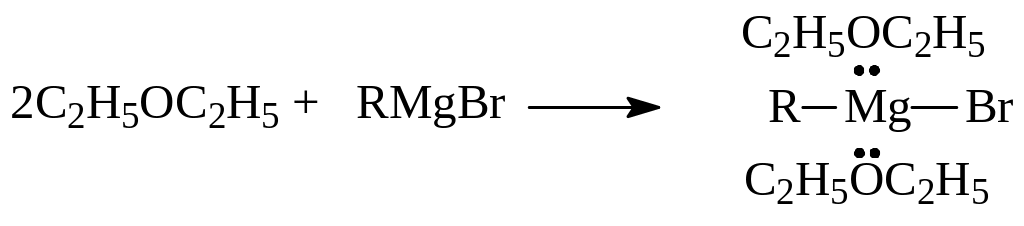
Наиболее важным представителем простых эфиров является диэтиловый эфир, широко применяемый в качестве растворителя различного назначения, а также как анестезирующее вещество. При применении эфира надо помнить, что он обладает высокой летучестью (темп. кип. 35,60), легко воспламеняется. Пары эфира почти в два с половиной раза тяжелее воздуха. При контакте с кислородом воздуха эфир образует взрывчатые гидроперекиси:
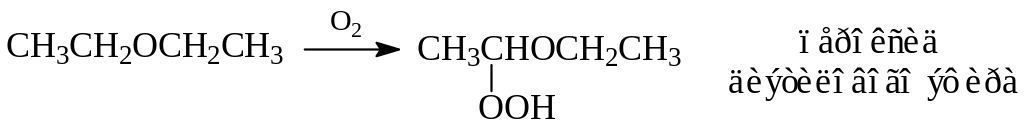
Гидроперекиси в эфире можно обнаружить встряхиванием образца с подкисленным иодистым калием. Побурение раствора свидетельствует о наличии гидроперекисей. Их удаляют обработкой с водным раствором сернокислого закисного железа или гидридом кальция.
