
- •5.2.1 Параметры состояния рабочего тела и законы идеальных газов
- •1 Краткая история создания поршневых двигателей внутреннего сгорания
- •2 Классификация двс
- •3 Требования к двигателям
- •4 Параметры и оценочные показатели двигателей
- •1) За счёт увеличения n посредством выбора соответствующих фаз газораспределения и настроек топливной аппаратуры;
- •2) За счёт увеличения mn посредством повышения цикловых подач топлива gт и воздуха gв;
- •3) Комбинация первых двух способов.
- •Теория двс
- •Основные понятия термодинамики
- •1) Совершение работы;
- •2) Теплообмен.
- •5.2 Параметры состояния рабочего тела и законы идеальных газов
- •5.2.1 Параметры состояния рабочего тела и законы идеальных газов
- •5.2.3 Первый закон термодинамики
- •5.2.4. Термодинамические процессы в идеальных газах
- •3. Связь между параметрами изотермического процесса определяется законом Бойля — Мариотта
- •6. Рабочие циклы двс
- •7 Теоретические термодинамические циклы
- •7.1. Цикл с подводом теплоты при постоянном объёме
- •7.2. Цикл с подводом теплоты при постоянном давлении
- •7.4. Циклы двигателей с турбонаддувом
- •Тема № 8. Топливо для двигателей самоходных машин
- •8.1 Структура топлива нефтяного происхождения
- •8.2 Требования к моторному топливу и его показатели оценки
- •1) Моторным (такой бензин обозначается буквой а с числом, которое показывает октановое число, то есть процентное содержание изооктана в смеси с гептаном эквивалентной данному бензину, например, а-76);
- •2) Исследовательским (обозначается двумя буквами аи, например, аи-93).
- •Тема № 9 Основы теории горения
- •9.1 Основные параметры горения топлива
- •0,78 И 0,21 - относительное объёмное содержание азота и кислорода в воздухе.
- •9.2 Виды горения
- •1) Диффузионно-цепной;
- •2) Тепловой.
- •1) Диффузионное горение несмешанных газов, где скорость горения в основном определяется скоростью перемешивания молекул топлива и окислителя;
- •2) Горение капель жидкого топлива, где началу горения предшествует испарение топлива и диффузионное перемешивание;
- •3) Горение твёрдого топлива, где процессу горения предшествует газификация (возгонка) топлива и его последующее перемешивание с окислителем.
- •9.3 Основы химической кинетики
- •9.4 Цепные химические реакции
- •9.5 Горение в дизелях
- •9.5.4 Горение в двигателях с принудительным воспламенением
- •Тема № 10. Токсичность двс
- •Тема № 11. Регулирование и характеристики двигателей самоходных машин
- •Путём изменения количества работающих цилиндров I;
- •Изменяя угловую скорость коленчатого вала д;
- •За счёт изменения среднего эффективного давления pe.
- •1) Количественное;
- •2) Качественное.
- •Нагрузочные, когда аргументом является среднее эффективное давление pe или мощность Nд;
- •Регулировочные, когда в качестве аргумента используется какой-либо регулируемый параметр, например, угол опережения зажигания н.
- •1) С всережимным регулятором двигателя врд (рис. 11.3,а);
- •2) С двухрежимным регулятором 2рд (рис. 11.3,б);
- •3) С многорежимным регулятором (рис. 11.3,в), в частности двигатель постоянной мощности (дпм).
- •Тема № 13. Термодинамический расчёт двс
- •Тема № 14. Кинематика и динамика кшм
- •Тема № 15. Кинематика и динамика грм
- •Тема № 16. Уравновешивание двигателей
- •Тема №17. Перспективы развития двигателей самоходных машин
3. Связь между параметрами изотермического процесса определяется законом Бойля — Мариотта
![]()
4. Так как Т1 =Т2, изменение внутренней энергии газа в изотермическом процессе равно нулю
и2-и1=о.
5. Совершенная 1 кг газа работа в изотермическом процессе, с учетом того что RT = const, определяется следующим образом:
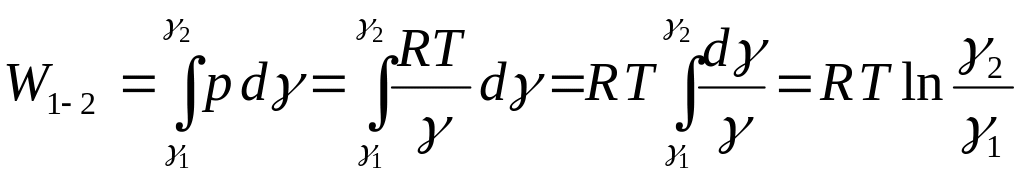 v>
v>
Пользуясь законом Бойля — Мариотта, получим
![]()
Для произвольной массы рабочего тела уравнение работы примет вид

Графически в р—-диаграмме работа в процессе 1—2 (см. рис. 1.8) определяется площадью под изотермой.
6. Теплота, участвующая в изотермическом процессе, определяется соотношением
![]()
Это означает, что вся подведенная в изотермическом процессе теплота расходуется на совершение работы.
Адиабатный процесс
Уравнение адиабатного процесса имеет вид
pvk = const,
где
![]() показатель адиабаты для идеального
газа
показатель адиабаты для идеального
газа
2. Графически адиабатный процесс на р—v-диаграмме изображается неравнобокой гиперболой, называемой адиабатой (рис. 1.9). Адиабата круче изотермы, так как к > 1.
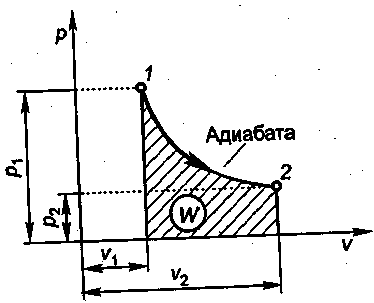
Рисунок 1.9 Адиабатный процесс
3. Связь между параметрами процесса определяем, используя уравнение адиабаты pvk = const и уравнение состояния газа pv=RT:
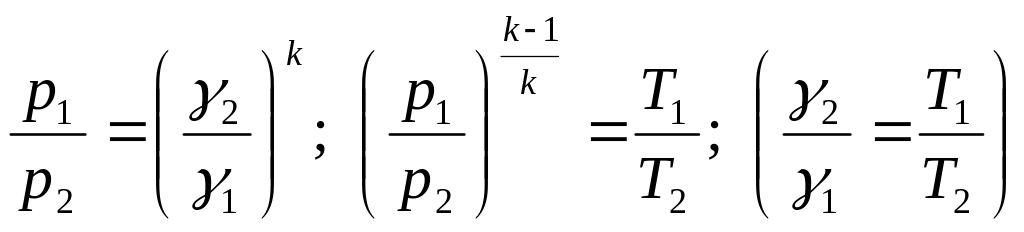
4. Изменение внутренней энергии для m кг вещества определяется по формуле
![]()
Работа в адиабатном процессе, совершенная 1 кг газа, может быть определена из уравнения первого закона термодинамики
![]()
Так как в адиабатном процессе q = 0, то |
![]()
т.е. работа расширения в адиабатном процессе совершается за счет уменьшения внутренней энергии газа.
6. Адиабатный процесс протекает без подвода теплоты, следовательно, Q = 0.
Политропный процесс
1. Уравнение политропного процесса имеет вид
pvn = const, (1.17)
где n — показатель политропы, который изменяется для разных процессов от 0 до ±.
Рассмотренные ранее процессы являются частными случаями политропных процессов (рис. 1.10):
если n= к, то pvk = const — адиабатный процесс; если n = 1, то
pv = const — изотермический процесс; если n = 0, то pv° =p= const — изобарный процесс;
если n= ±, то представив pvn = const как p1/n v = const, имеем
![]() —
изохорный процесс.
—
изохорный процесс.
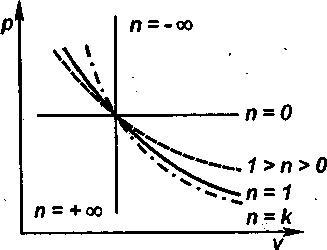
Рис. 1.10. Совмещенный график процессов изменения состояния газов на p-v-диаграмме
Показатель изотропы п можно определить, если известны два состояния в политропном процессе
![]()
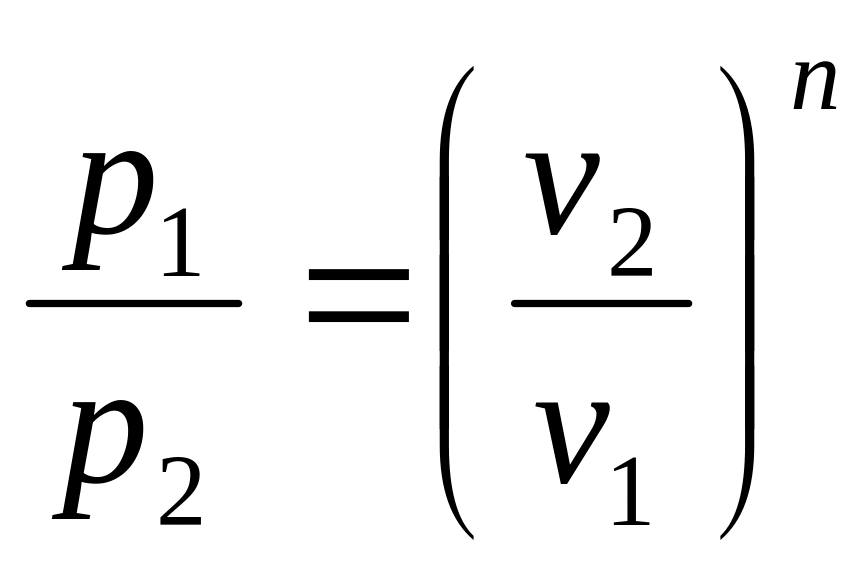
![]() (1.18)
(1.18)
2. Графическое изображение политропного процесса в р-v-диаграмме имеет вид кривой, которая называется политропой.
3 Соотношение параметров данного процесса можно получить, заменив в уравнениях адиабатного процесса показатель степени к на показатель п:
![]()
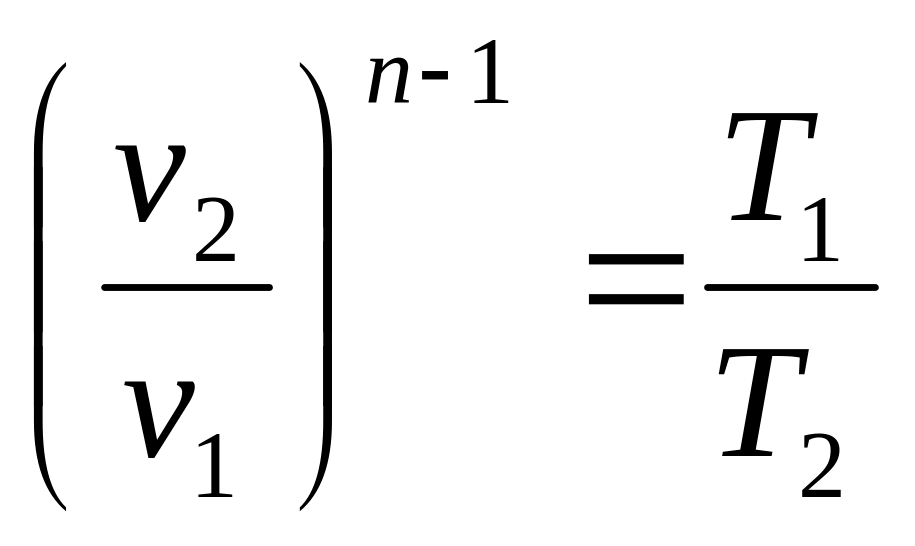

4.Изменение внутренней энергии в политропном процессе для произвольной массы вещества определяется по формуле
![]()
![]()
5. Работа изменения объема в политропном процессе для 1 кг рабочего тела равна

или, учитывая уравнение состояния Клапейрона,
![]()
Для произвольной массы газа
![]()
6.Количество теплоты в политропном процессе для m кг вещества определяется выражением, полученным в соответствии с первым законом термодинамики
![]()
