
- •5.2.1 Параметры состояния рабочего тела и законы идеальных газов
- •1 Краткая история создания поршневых двигателей внутреннего сгорания
- •2 Классификация двс
- •3 Требования к двигателям
- •4 Параметры и оценочные показатели двигателей
- •1) За счёт увеличения n посредством выбора соответствующих фаз газораспределения и настроек топливной аппаратуры;
- •2) За счёт увеличения mn посредством повышения цикловых подач топлива gт и воздуха gв;
- •3) Комбинация первых двух способов.
- •Теория двс
- •Основные понятия термодинамики
- •1) Совершение работы;
- •2) Теплообмен.
- •5.2 Параметры состояния рабочего тела и законы идеальных газов
- •5.2.1 Параметры состояния рабочего тела и законы идеальных газов
- •5.2.3 Первый закон термодинамики
- •5.2.4. Термодинамические процессы в идеальных газах
- •3. Связь между параметрами изотермического процесса определяется законом Бойля — Мариотта
- •6. Рабочие циклы двс
- •7 Теоретические термодинамические циклы
- •7.1. Цикл с подводом теплоты при постоянном объёме
- •7.2. Цикл с подводом теплоты при постоянном давлении
- •7.4. Циклы двигателей с турбонаддувом
- •Тема № 8. Топливо для двигателей самоходных машин
- •8.1 Структура топлива нефтяного происхождения
- •8.2 Требования к моторному топливу и его показатели оценки
- •1) Моторным (такой бензин обозначается буквой а с числом, которое показывает октановое число, то есть процентное содержание изооктана в смеси с гептаном эквивалентной данному бензину, например, а-76);
- •2) Исследовательским (обозначается двумя буквами аи, например, аи-93).
- •Тема № 9 Основы теории горения
- •9.1 Основные параметры горения топлива
- •0,78 И 0,21 - относительное объёмное содержание азота и кислорода в воздухе.
- •9.2 Виды горения
- •1) Диффузионно-цепной;
- •2) Тепловой.
- •1) Диффузионное горение несмешанных газов, где скорость горения в основном определяется скоростью перемешивания молекул топлива и окислителя;
- •2) Горение капель жидкого топлива, где началу горения предшествует испарение топлива и диффузионное перемешивание;
- •3) Горение твёрдого топлива, где процессу горения предшествует газификация (возгонка) топлива и его последующее перемешивание с окислителем.
- •9.3 Основы химической кинетики
- •9.4 Цепные химические реакции
- •9.5 Горение в дизелях
- •9.5.4 Горение в двигателях с принудительным воспламенением
- •Тема № 10. Токсичность двс
- •Тема № 11. Регулирование и характеристики двигателей самоходных машин
- •Путём изменения количества работающих цилиндров I;
- •Изменяя угловую скорость коленчатого вала д;
- •За счёт изменения среднего эффективного давления pe.
- •1) Количественное;
- •2) Качественное.
- •Нагрузочные, когда аргументом является среднее эффективное давление pe или мощность Nд;
- •Регулировочные, когда в качестве аргумента используется какой-либо регулируемый параметр, например, угол опережения зажигания н.
- •1) С всережимным регулятором двигателя врд (рис. 11.3,а);
- •2) С двухрежимным регулятором 2рд (рис. 11.3,б);
- •3) С многорежимным регулятором (рис. 11.3,в), в частности двигатель постоянной мощности (дпм).
- •Тема № 13. Термодинамический расчёт двс
- •Тема № 14. Кинематика и динамика кшм
- •Тема № 15. Кинематика и динамика грм
- •Тема № 16. Уравновешивание двигателей
- •Тема №17. Перспективы развития двигателей самоходных машин
5.2.3 Первый закон термодинамики
Прежде чем сформулировать первый закон термодинамики, рассмотрим такие понятия, как термодинамический процесс, работа процесса, внутренняя энергия.
Под термодинамическим процессом понимают последовательное изменение состояния рабочего тела, которое происходит под влиянием механического (сжатие или расширение) или термического (нагрев или охлаждение) воздействия окружающей среды.
Различают равновесные и неравновесные процессы. Под, равновесным понимают процесс, который протекает с бесконечно малой скоростью так, что в каждый момент времени в рабочем теле успевает установиться равновесное состояние, т.е. такое состояние, при котором во всех точках рабочего тела параметры имеют одинаковые, не изменяемые во времени значения. Термодинамика изучает в основном равновесные процессы. Равновесный процесс есть процесс идеальный.
Равновесные процессы называют обратимыми, так как они могут протекать сначала в прямом, а затем в обратном направлении через одну и ту же последовательность равновесных состояний. При этом вся система тел, принимающих участие в процессах, возвращается в свое первоначальное состояние без дополнительных затрат энергии.
Под неравновесным процессом понимают все действительные (реальные) процессы, в которых рабочее тело проходит через неравновесные состояния. Неравновесные процессы называют необратимыми.
В технической термодинамике изучают главным образом процессы, которые подчиняются уравнению состояния идеального газа. При изучении необратимых (реальных) процессов можно пользоваться результатами исследований обратимых процессов, вводя опытные коэффициенты, которые учитывают отклонения необратимых процессов от обратимых.
Обратимые (равновесные) процессы изображают графически в прямоугольной системе p—v координат. Такие графики называют диаграммами состояния. Очевидно, что на этой диаграмме состояние рабочего тела может быть изображено точкой, а последовательное изменение состояний, т.е. процесс, — линией, характер которой зависит от условий протекания процесса.
Работа расширения или сжатия газа. Рассмотрим процесс изменения параметров рабочего тела в цилиндре со свободно перемещающимся поршнем (рис. 1.5). Представим, что в цилиндре находится 1 кг газа с начальными параметрами р1, v1. T1 . Это состояние газа на p—v-диаграмме изобразим точкой 1. Давление газа на поршень в начальном состоянии уравновешивается внешней силой Рвн, приложенной к штоку поршня, и давлением атмосферы. При уменьшении внешней силы поршень под действием давления газов начнет перемещаться в цилиндре вправо, увеличивая объем газа до 2 и уменьшая давление и температуру до р2 и Т2. Состояние газа в конце процесса расширения изобразим точкой 2. Соединив все точки промежуточных состояний между точками 1 и 2, получим кривую 1—2 процесса расширения газа.
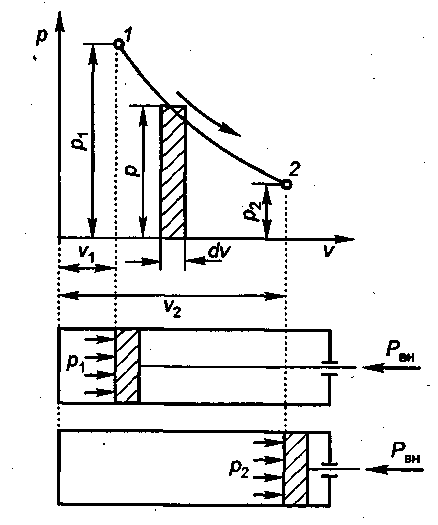
Чтобы определить работу расширения или сжатия газа, разобьем процесс расширения на бесконечно малые участки, в пределах которых давление принимают постоянным. Тогда величина элементарной работы dw при бесконечно малом перемещении поршня dx равна произведению силы на путь:
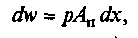
где р — давление газа на площадь днища поршня, Па; Ап — площадь днища поршня, м2.
Так как Andx = dv, то dw = pdv, где dv — приращение объема в элементарном процессе.
Интегрируя это уравнение в пределах от 1, до 2, получим значение полной работы расширения или сжатия 1 кг газа
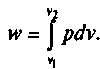
Для произвольного количества газа массой m (кг) работа расширения или сжатия будет составлять
W=mw. (1.10)
В р—v-диаграмме полная работа расширения или сжатия характеризуется площадью, расположенной под кривой процесса и ограниченной двумя линиями, параллельными оси ординат, и осью абсцисс. Работа расширения газа считается положительной, а работа сжатия — отрицательной.
Внутренняя энергия газа. Рабочее тело, находясь в любом состоянии, обладает определенным запасом внутренней энергии. Под внутренней энергией понимают все виды энергии, связанные с внутренним движением молекул: кинетическую энергию поступательного и вращательного движения молекул, потенциальную энергию молекул.
У идеального газа отсутствуют силы взаимодействия между молекулами и, следовательно, потенциальная энергия его молекул равна нулю. Значит, внутренняя энергия идеального газа не зависит от характера процесса, а зависит только от температуры газа и является функцией состояния
![]()
Термодинамику обычно интересует не абсолютное значение внутренней энергии в данный момент, а ее изменение в процессе
![]()
где U2-U1— разность внутренних энергий газа в начале и в конце процесса.
Первый закон термодинамики — одна из формулировок универсального закона сохранения и превращения энергии, открытого М.В. Ломоносовым (1748). Этот закон устанавливает, что взаимный переход теплоты в работу и работы в теплоту совершается в равнозначных количествах:
Q=W, где Q — количество теплоты, Дж; W — количество работы, Дж.
Рассмотрим замкнутую термодинамическую систему, в которой не происходит обмена массой между рабочим веществом и внешней средой. Если к рабочему телу этой системы подвести какое-то количество теплоты, то часть ее будет расходоваться на нагревание рабочего тела, т.е. на увеличение его температуры и, следовательно, на изменение внутренней энергии. Другая часть теплоты идет на увеличение объема рабочего тела и, значит, на совершение внешней работы.
Первый закон термодинамики может быть сформулирован таким образом: вся теплота, подведенная к телу, расходуется на изменение его внутренней энергии и на совершение внешней работы. Формула первого закона термодинамики для произвольного количества вещества имеет следующий вид:
![]()
