
- •Кинетика химических реакций. Формальная кинетика. Скорость реакции. Кинетическое уравнение. Константа скорости. Порядок реакции. Реакции нулевого, первого и второго порядка. Период полупревращения.
- •Скорость реакции
- •Кинетическое уравнение
- •Молекулярность и порядок химической реакции.
- •Кинетика реакций в статических условиях
- •Реакция нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Механизмы химических реакций.
- •Методы определения порядка химических реакций
- •Интегральные методы
- •Дифференциальные методы (Метод Вант Гоффа)
- •Сложные реакции
- •Обратимые реакции
- •Последовательные реакции
- •Параллельные реакции
- •Сопряженные реакции
- •Цепные реакции
- •Теория активированного комплекса
- •Влияние растворителя на кинетику химической реакции
Сложные реакции
Кинетика сложных реакций зависит от формы связи между простыми реакциями, от соотношения их скоростей и основывается на принципе независимости простых реакций. Согласно этому принципу, если в системе протекают одновременно несколько реакций, то каждая из них не зависит от других и ее скорость определяется кинетическими уравнениями простых реакций.
Обратимые реакции
Обратимыми называются реакции, одновременно протекающие в двух противоположных направлениях.
Скорость обратимой реакции равна разности скоростей прямой и обратной реакций. Рассмотрим обратимую реакцию первого порядка:
kA
А ====== В
kB
В результате прямой реакции концентрация В растет, в результате обратной падает. Выразим скорость суммарной реакции через концентрацию В получим:
![]() (28)
(28)
Состояние равновесия, характеризуется равенством скоростей прямой и обратной реакций:
![]() (29)
(29)
Символ “ - означает равновесные концентрации участников реакции. Тогда константу скорости прямой реакции можно выразить так:
![]() (30)
(30)
Последовательные реакции
Последовательными реакциями называют реакции, состоящие из нескольких стадий, следующих друг за другом.
Если какая-либо стадия протекает значительно медленнее других, то ее скорость и порядок определяют скорость и порядок всей реакции. Две последовательные реакции первого порядка можно представить схематически:
k1 k2
А В С
Если скорости стадий соизмеримы, то для определения зависимости концентрации от времени следует написать кинетические уравнения для каждой стадии, а затем решить их совместно. Аналитической решение задачи связано с определенными сложностями, поэтому рассмотрим только качественные результаты. Качественный характер изменения концентраций от времени представлен на рисунке.
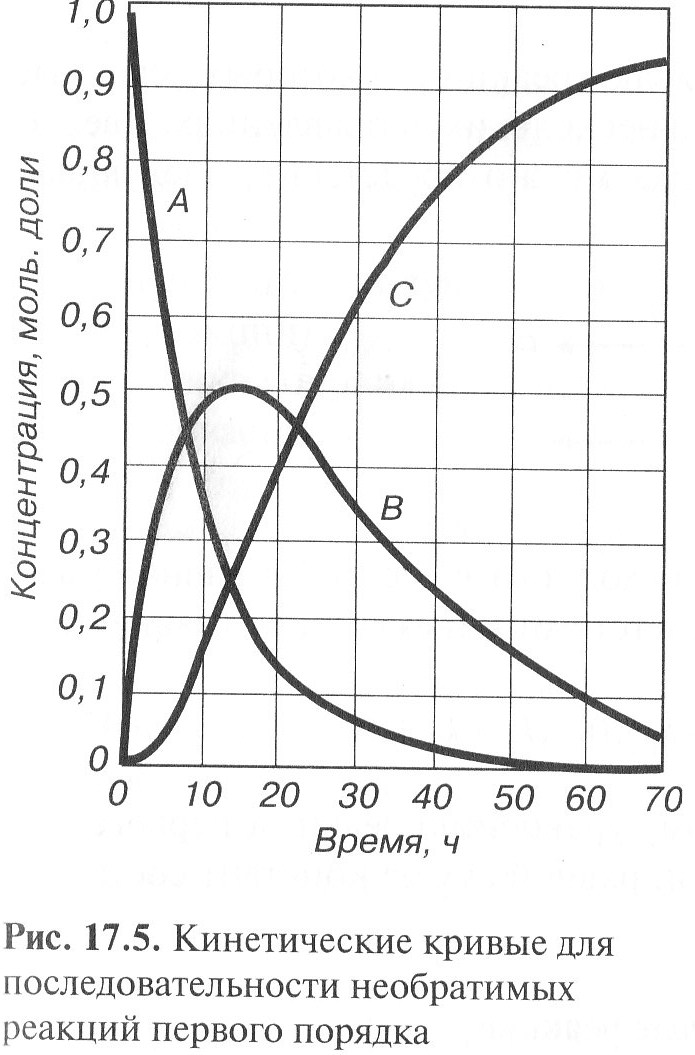
Концентрация вещества А экспоненциально убывает со временем. Концентрация В – проходит через максимум, и снова падает, т. к вещество В полностью превращается в С. Скорость образования С в любой момент пропорциональна концентрации В. Вначале она равна нулю, затем проходит через максимум, когда концентрация В максимальна, а в конце реакции снова приближается к нулю. На этой кривой С имеется период, в течение которого не происходит образования С. Существование такого периода указывает на то, что продукт реакции образуется через промежуточное соединение.
Наибольшее количество промежуточного вещества В не зависит от абсолютных скоростей реакций, а определяется их отношением. Чем больше k1/k2, тем больше максимум. Кривая С имеет точку перегиба. В течение некоторого времени, называемого периодом индукции, продукт реакции практически не образуется (кривая идет почти сливаясь с осью). Расчеты показывают, что чем меньше отношение k1/k2, тем больше период индукции.
Параллельные реакции
Реакции называют параллельными, если исходные вещества одновременно реагируют в нескольких направлениях.
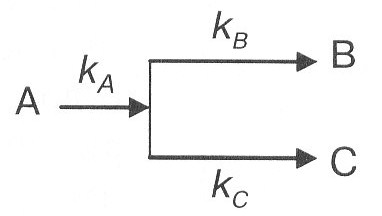
Полная скорость превращения исходного вещества А равна сумме двух скоростей, т.е.
![]() (31)
(31)
В этом случае кинетическое уравнение тождественно кинетическому уравнению первого порядка с константой скорости, равной сумме констант составляющих реакций.
