
15.03.2012 г.
Ковалюк Т.В., 25Б111(2) группа
Лабораторная работа № 2
«Определение содержания Fe (II) в анализируемом растворе методом прямого окислительно-восстановительного титрования»
Цель работы: определить содержание Fe (II) в анализируемом растворе методом прямого ОВР-титрования.
Оборудование и реактивы:
Бюретка вместимостью 25,00 см3
Конические колбы для титрования вместимостью 250 см3
Пипетка Мора вместимостью 10,00 см3
Мерный цилиндр вместимостью 25 или 50 см3
Стакан вместимостью 100-150 см3
Воронка
Капельница
промывалка
Анализируемый раствор Fe (II)
Раствор перманганата калия с точно известной концентрацией
Раствор серной кислоты (C=2 н.)
Титрант: раствор перманганата калия (C=0,05048 н.)
Определяемое вещество: Fe (II)
Индикатор: безиндикаторный метод
Уравнение реакции титрования:

 -
окислитель, восстановление
-
окислитель, восстановление
 -
восстановитель, окисление
-
восстановитель, окисление
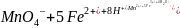
fэкв.(
КMnO4)= ;
M(1/5КMnO4)=
31,61 г/моль;
;
M(1/5КMnO4)=
31,61 г/моль;
fэкв.(Fe)=1; M(Fe)=55,85 г/моль.
Теоретическая часть
Методы окислительно-восстановительного титрования, или редоксиметрии, основаны на количественном окислении или восстановлении определяемых веществ. Эти методы нашли широкое применение в анализе. В них используются реакции, при которых происходит перенос одного или нескольких электронов от одного иона (атома, молекулы) к другому иону (атому, молекуле). При этом число электронов, отданных одной частицей, должно быть эквивалентно количеству электронов, принятых другой. В результате такого перераспределения электронов происходит изменение степени окисления частиц, участвующих в химической реакции. Степень окисления восстанавливающихся частиц понижается (данные частицы являются окислителями), а степень окисления окисляющихся частиц (восстановителей) повышается.
Любую окислительно-восстановительную реакцию можно представить в виде двух отдельных полуреакций. Полуреакция – это уравнение переноса электронов между двумя различными степенями окисления одного и того же элемента.
Электроны могут передаваться не только от одной частицы к другой, но также и путем присоединения или отщепления электроноакцепторной частицы (атом кислорода, молекула хлора и т.п.) или электронодонорной частицы (молекула водорода, атом металла и т.д.).
Так как свободные электроны не могут накапливаться в реакционной системе, то окислительный процесс всегда сопровождается одновременно другим процессом - восстановительным.
Методы редоксиметрии:
а) в зависимости от используемых титрантов, подразделяются на:
Перманганатометрию. Титрант – раствор перманганата калия КMnO4. Индикатор – избыточная капля титранта.
Иодометрию. Титрант – раствор свободного иода I2 или тиосульфата натрия Na2S2O3. Индикатор – крахмал.
Дихроматометрию, которая основана на использовании в качестве рабочего раствора дихромата калия (K2Cr2O7). Метод может применяться как для прямых, так и косвенных определений восстановителей.
Броматометрию, которая основана на использовании в качестве титранта бромата калия (KBrO3) при определении восстановителей.
Ванадатометрия дает возможность использовать окислительную способность ванадата аммония (NH4VO3). Кроме перечисленных методов в лабораторной практике используются и такие методы как цериметрия (Ce4+), титанометрия и другие.
Иодатометрия применяет в качестве рабочего раствора раствор иодата калия (KIO3) при определении восстановителей.
б) по способу титрования различают:
Прямое титрование. При прямом титровании титрант непосредственно добавляют к титруемому веществу.
Обратное титрование. При обратном титровании к определяемому веществу добавляется заведомый избыток титранта.
Заместительное титрование. При заместительном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют один из продуктов реакции между анализируемым веществом и добавленным реагентом.
Окислительно-восстановительный индикатор, как и в методе нейтрализации, выбирают на основании кривой титрования. Для титрования следует брать такой индикатор, изменение окраски которого будет включать в себя значение потенциала в точке эквивалентности. При титровании необходимо учитывать, что процесс перехода электронов между окисленной и восстановленной формами происходит довольно медленно, поэтому скорость титрования, особенно вблизи точки эквивалентности, должна быть невысокой.
Точка эквивалентности окислительно-восстановительного титрования фиксируется как с помощью индикаторов, так и безиндикаторным способом. Безиндикаторный способ применяется в тех случаях, когда окисленная и восстановленная формы титранта отличаются. В точке эквивалентности, при введении 1 капли избытка раствора титранта изменит окраску раствора.
Безындикаторным способом можно проводить определения перманганатометрическим методом, т.к. в точке эквивалентности от одной капли раствора перманганата калия титруемый раствор окрашивается в бледно-розовый цвет. При индикаторном способе фиксирования точки эквивалентности применяют специфические и редокс-индикаторы. К специфическим индикаторам относится крахмал в иодометрии, который в присутствии свободного иода окрашивается в интенсивно-синий цвет вследствие образования адсорбционного соединения синего цвета.
Редокс-индикаторы – это вещества, у которых окраска меняется при достижении определенного значения окислительно-восстановительного (редокспотенциала). К редокс-индикаторам относится, например, дифениламин NH(C6H5)2. При действии на бесцветные растворы его окислителями он окрашивается в сине-фиолетовый цвет.
Редокс-индикаторам предъявляют следующие требования:
окраска окисленной и восстановленной формы должна быть различна;
изменение цвета должно быть заметно при небольшом количестве индикатора;
индикатор должен реагировать в точке эквивалентности с весьма небольшим избытком восстановителя или окислителя;
интервал действия его должен быть как можно меньше;
индикатор должен быть устойчив к воздействию компонентов окружающей среды (О2, воздуха, СО2, света и т.п.).
В основе перманганатометрии лежит реакция окисления различных восстановителей рабочим раствором перманганата калия, т.е. ионом MnO4-. Окисление может проводиться в кислой, щелочной и нейтральной среде.
Кислая среда:

Щелочная среда:

Слабощелочная или нейтральная среда:

В то время как при титровании в кислой среде образуются почти бесцветные ионы Mn2+, в слабощелочной или нейтральной среде выпадает темно-бурый осадок MnO2, что сильно затрудняет фиксирование точки эквивалентности.
Кроме того, окислительная способность перманганата калия в кислой среде гораздо выше, чем в щелочной. Поэтому в перманганатометрии используют чаще всего реакции окисления перманганатом в кислой среде. При титровании перманганатом не применяют индикаторы, так как реагент сам окрашен и является чувствительным индикатором.
Для определения концентрации титранта используют растворы с точно известным содержанием (стандартные растворы): Na2C2O4, As2O3 (в присутствии KIO3 в качестве катализатора), FeSО4·(NH4)2SO4·6H2O и K4[Fe(CN)6]·3H2O.
Перманганатометрию применяют для определения: Fe (II), Sb (III), Mn (II), V (IV), W (V), U (IV), Tl (I), Cr (III), H2O2, H2C2O4 и ее солей, арсенитов, гидразина и ряда орг. веществ (например, хлоруксусной и пропионовой кислот в щелочной среде); обратным перманганатометрическим титрованием определяют восстановители, медленно реагирующие с KMnO4, – иодиды, цианиды, фосфиты.
Приготовить титрованный раствор перманганата по точной навеске нельзя, так как твердый KMnO4 всегда в какой-то степени загрязнен диоксидом марганца MnO2. Кроме того, он легко разлагается под влиянием восстановителей – аммиака, органических веществ, попадающих в воду. Вследствие этого концентрация раствора KMnO4 в первое время после приготовления несколько уменьшается. Перманганат окисляет саму воду:

Процесс окисления воды медленный, но ускоряется при нагревании, освещении, под действием кислот, оснований, ионов Mn+2 и MnO2 (автокатализ). Необходимо свести влияние всех этих факторов к минимуму. Для этого нужно соблюдать следующие правила работы с раствором перманганата калия:
1) титр раствора перманганата калия устанавливают не ранее, чем через 7-10 дней после его приготовления;
2) периодически удаляют осадок MnO2, содержащийся в растворе перманганата, т.к. он каталитически ускоряет разложение KMnO4 (удаляют фильтрованием через стеклянный фильтр;
3) не допускают соприкосновения раствора перманганата калия с резиной, бумагой, т.к. KMnO4 окисляет эти вещества;
4) хранят раствор перманганата в темноте или в склянке из темного стекла;
5) стандартизируют раствор через каждые 1-2 недели.
В качестве первичного стандарта при стандартизации раствора перманганата калия используют раствор оксалата натрия (Na2C2O4) или щавелевой кислоты (Н2С2О4). В кислом растворе перманганат окисляет щавелевую кислоту до углекислого газа и воды. При этом суммарная реакция выражается уравнением:
2КMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + 8H2O + K2SO4
Окисление оксалат-ионов происходит по схеме:
С2О42– – 2е- 2СО2
Используя перманганатометрию, можно определять содержание в растворе различных восстановителей, например, ионов Fe2+, Sn2+. Данное определение основано на реакции:
MnO4– + 5Fe2+ + 8H+ Mn2+ + 5Fe3+ + 4H2O
Титрование ведут в кислой среде (для этого раствор подкисляют серной кислотой).
При титровании раствора железа раствором перманганата калия в точке эквивалентности количество вещества эквивалента железа равно количеству вещества эквивалента перманганата калия:

Количества вещества эквивалента определяемого вещества (Fe) и титранта (KMnO4) можно выразить следующим образом:
 и
и
 =
=
Тогда в точке эквивалентности:

Поскольку для титрования была взята только часть анализируемого раствора, нужно учесть коэффициент разбавления пробы (V0/Vx), тогда:
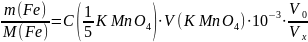
Следовательно, масса железа (г) в анализируемом растворе рассчитывается по формуле:

