
- •1. Адсорбция. Основные понятия и определение
- •2. Адсорбенты
- •Ионообменний метод очистки воды План.
- •1. Определение метода. Общие понятия.
- •2. Селективность ионов. Теория Грегора.
- •1. Определение метода. Общие понятия
- •2. Селективность ионитов. Теория Грегора
- •Лекция 12(ч.2) Определение емкости ионита. План
- •Определение емкости ионита в статических условиях.
- •Определение емкости ионита в динамических условиях.
- •Регенерация ионита.
- •Определение емкости ионита в статических условиях.
- •2. Определение адсорбционной емкости в динамических условиях.
- •3. Регенерация ионита.
3. Регенерация ионита.
Процесс восстановления емкости ионита является очень важным этапом ионообменного очистки воды. Учитывая высокую стоимость ионообменных материалов, можно сказать, что применение ионита может быть экономически целесообразным лишь при эффективной регенерации ионита.
Процесс регенерации ионита сводится к переведению ионита в исходную форму после исчерпания его емкости в процессе ионообмена. Для катионов, которые используются в кислой форме процесс ионного обмена можно описать уравнением:
ПSO 3-Н+ + NaCl ↔П SO3-Na+ + NaCl
Процесс регенерации осуществляют при обработке ионита 5 ÷ 7%- ими растворами кислоты при излишке кислоты 2 ÷ 3 г-экв на один г-экв емкости ионита. Т.е.:
ПSO3-Na+ + nNaCl ↔ ПSO 3-Н+ + NaCl +(n-1) HCl
Где n = 2÷3
Для переведения катионита в исходную Na+ - форму его обрабатывают ≈ 10% - им раствором хлорида натрия.
(ПSO3 )2Ca2+ + mNaCl ↔ 2ПSO3-Na+ + CaCl2 +(m-2) NaCl
Для переведения анионита в исходную ОН¯ – форму ионит обрабатывают 4%-им раствором щелочи.
П- N+(CH3) 3Cl- + xNaOH ↔ ПN(CH3) 3OH- + NaCl +(x-1) NaOH
Для переведения ионита в Cl-, форму его обрабатывают растворами хлорида натрия.
П- N+(CH3) 3Cr2 O72-Na+ + yNaCl ↔ ПN(CH3) 3Cl- + Na2Cr2 O7-+(y-1) NaCl
Таким образом из уравнений видно, что регенерационные растворы содержат кроме сорбированных ионов остатки реагентов, которые использовались для регенерации ионита.
Переработка таких отработанных регенерационных растворов, которые всегда являются сложными смесями является отдельной интересной темой. На в самом деле, без решения проблемы утилизации регенерационных растворов применение ионного обмена не возможно.
Процесс регенерации ионита описывается исходной кривой десорбции ионов. Кривая строится как зависимость концентрации ионов, которые десорбируюся из объема пропущенного регенерационного раствора, или относительной затраты регенерационного раствора, который определяется как отношение объема регенерационного раствора к объему ионита.
qn= Vp.p./Vи
где Vр.р. - объем пропущенного регенерационного раствора;
Vи- объем ионита.
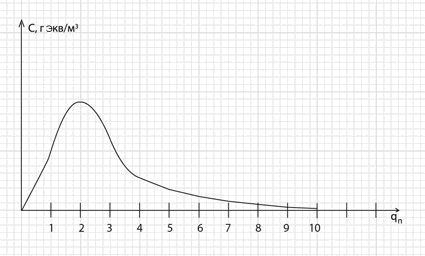
Рис. 2. Исходная кривая десорбции ионов при регенерации ионита.
Как видно из исходной кривой десорбции, основная масса сорбированных ионов вымывается при qп = 3 ÷ 4. Это происходит при удачно выбранной концентрации регенерационного раствора. Об эффективности десорбции можно судить по зависимости степени десорбции (Z, %) от удельной затраты регенерационного раствора (qп).
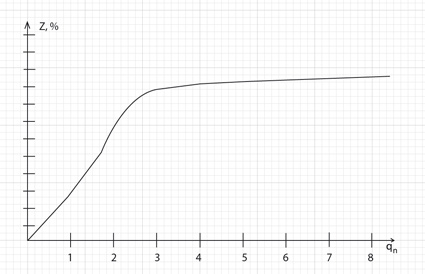
Рис.3. Зависимость степени десорбции ионов от удельной затраты регенерационного раствора.
Как видно из рис.3., при удачно выбранной концентрации регенерационного раствора основная масса ионов десорбируется при qп = 3 ÷ 4 (Z > 90 %)
Степень десорбции рассчитывают исходя из массы сорбированных ионов (m g,c,и). При пропускании определенного объема регенерационного раствора и массы сорбированных ионов (m c.и.)
![]()
Массу десорбированных ионов рассчитывают исходя из объема отобранного регенерационного раствора (Vр) и концентрации ионов в нем (Cи)
m д.c.и = Vр* Cи
При этом масса десорбированных ионов рассчитывается для каждой отобранной пробы. Для нескольких проб (п), масса десорбированных ионов при пропуске n проб раствора рассчитывается как сумма:
![]()
Исходя из этого можно определить степень регенерации в зависимости от пропущенного объема регенерационного раствора:
![]()
![]()
![]()
Технологическая схема ионообменного обессоливания воды.
Эта технология применяется при подготовке энергетической воды, изъятии тяжелых металлов из воды, а также органических и неорганических загрязнителей, которые находятся в воде в ионном состоянии.
Ионообменная технология включает стадии:
- катионирования (удаление катионов);
- анионирование (удаление анионов).
Для достижения глубокого обессоливания воды используют фильтры смешанного действия, в которые загружается смесь катионита и анионита. Как правило, на ионообменные установки подают воду, которую предварительно умягчают реагентным методом.
Принципиальная технологическая схема ионообменного обессоливания воды приведенная на рис. 3.
Преимущество ионного обмена - простота процесса. Недостаток - необходимость переработки и утилизации кислых и щелочных стоков, а также утилизации засоленных стоков после нейтрализации.
Любой ионообменный процесс - периодический. Ионообменный фильтр работает до насыщения его ионами, а потом направляется на регенерацию, перед которой через ионообменный материал пропускают воду (напором) для вспушивания ионита. Потом через него пропускают регенерационные растворы: для катіоніту - NаСl, Н2SО4, НСl с концентрациями кислот 7-8 %, NаСl используют насыщенный; для анионита - щелочь с концентрацией 4 %.
После регенерации ионит промывают водой от избытка регенерационного раствора. После промывки ионит пригоден для повторного использования.
Фильтр смешанного действия регенерируют противоположными потоками щелочи и кислоты.
Расход регенерационных растворов одинаковый.
Процесс регенерации для фильтров смешанного действия основан на том, что использованный анионит легче катионита, поэтому при вспушивании анионит собирается вверху, а катионит - внизу.
Данная технология обессоливания воды предусматривает двухступенчатое катионирование и двухступенчатое анионирование. Этот подход реализуется для обеспечения более полного обессоливания воды и уменьшения расходов реагентов на регенерацию ионообменных материалов.
Низкоосновные аниониты легче регенерируются щелочью по сравнению с высокоосновными, что позволяет применять реагенты низких концентраций при небольшом избытке реагента (небольшом удельном расходе).
Такая же закономерность и при регенерации слабокислотных и средней силы катионов по сравнению с сильнокислотными.
Многозарядные ионы удаляются с сильнокислотного катионита значительно тяжелее, чем однозарядные, поэтому на І стадии катионирования целесообразно использовать слабокислотные и средней силы катиониты в Н+-форме. На этих ионитах задерживаются катионы Са2+ и Мg2+; на ІІ стадии применяют сильнокислотные катиониты, которые сорбируют Nа+, К+, NН4+,...
Если постоянная жесткость воды высокая на І стадии катионирования используют сильнокислотные катиониты, так как при этих условиях слабокислотные и средней силы катиониты плохо сорбируют ионы Са2+ и Мg2+.
Если на І стадии используют сильнокислотные катиониты, то двухступенчатое катионирование является целесообразным, так как дает возможность значительно сократить расход реагента на регенерацию катионных фильтров ІІ ступени, на которые сорбируются однозарядные катионы. Для десорбции К+ удельный расход реагента в 2-3 раза меньше, чем для многозарядных катионов.
При катионировании воды катиониты используют в Н+-форме, которая приводит к подкислению воды.
На І стадии анионирования целесообразно использовать низкоосновные аниониты, которые эффективно связывают сильные и средней силы кислоты:
П - NН2 + НС1 ↔ П - NН3+С1-.
На ІІ стадии анионирования применяют высокоосновные аниониты для извлечения из воды анионов слабых кислот:
2П - N+(СН3)3ОН- + Н2SіО3 ↔ (П - N+(СН3)3)2SіО32- + Н2О.
Для глубокого деионирования воды используют фильтры смешанного действия (сильно кислотные катиониты и высокоосновные аниониты).
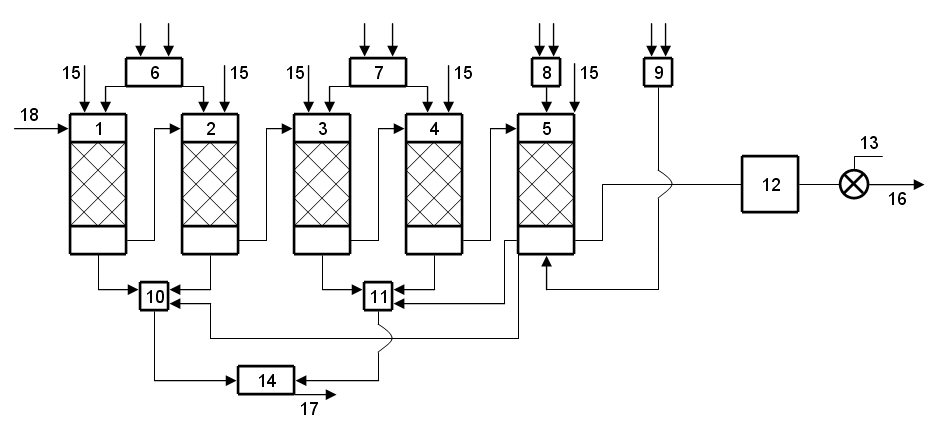
1 - катионообменный фильтр І степени;
2 - катионообменный фильтр ІІ степени;
3 - анионообменный фильтр І степени;
4 - анионообменный фильтр ІІ степени;
5 - фильтр смешанного действия;
7, 8 - резервуары с раствором щелочи для регенерации анионов;
6, 9 - резервуары с раствором кислоты для регенерации катионов;
10 - резервуары кислых стоков;
11 - резервуары щелочных стоков;
12 - резервуары осветленной воды;
13 - насос;
14 - нейтрализатор;
15 - подача воды на промывку фильтров;
16 - подача обессоленной воды к потребителю;
17 - отвод нейтральных стоков на утилизацию;
18 - подача реагентно умягченной воды на обессоливание.
