
Фармакопейная характеристика препарата (ГФ 10)
Glucosum
Глюкоза
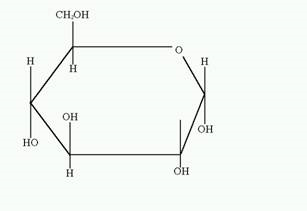
C6H12O6·H2O M. в. 198,17
Свойства. Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Растворим в воде, трудно растворим в 95% спирте, хлороформе, практически нерастворим в эфире.
Испытание на подлинность. К раствору 0,2г препарата в 5 мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично-красный осадок.
Удельное вращение от +51,50 до +530 (10% водный раствор). Препарат предварительно сушат при 100-1050 до постоянного веса. Измерение угла вращения производят после прибавления к раствору препарата 2 капель раствора аммиака.
Испытание на чистоту. 5 г препарата растворяют в 25 мл воды. Полученный раствор должен быть прозрачным и бесцветным. Полученный выше раствор разводят водой до 100 мл.
При прибавлении к 10 мл этого раствора нескольких капель раствора фенолфталеина и 0,05 мл 0,01 н. раствора едкого натра должно появиться розовое окрашивание (предел кислотности).
2 мл того же раствора, разбавленные водой до 10 мл, не должны содержать более чем 10 мл эталонного раствора, т.е. не более 0,02% в препарате.
10 мл того же раствора должны не должны содержать сульфатов более чем 10 мл эталонного раствора, т.е. не более 0,02% в препарате.
10 мл того же раствора не должны давать реакции на кальций.
К 10 мл того же раствора прибавляют 0,5 мл разведенной соляной кислоты и 0,5 мл разведенной серной кислоты; раствор не должен изменяться в течение 15 минут (барий).
2 г препарата растворяют при нагревании в 3 мл воды. После прибавления к 1 мл этого раствора 3 мл спирта раствор должен оставаться прозрачным (декстрин).
Около 0,5 г препарата (точная навеска) сушат при 100-1050 до постоянного веса. Потеря в весе не должна превышать 10%.
Сульфатная зола из 1 г препарата не должна превышать 0,1% и не должна содержать тяжелых металлов более чем 10 мл эталонного раствора, т.е. не более 0,0005% в препарате.
0,5 г препарата не должны давать реакции на мышьяк.
Хранение. В хорошо закупоренных банках, в сухом месте.
Примечание. При изготовлении растворов для инъекций:
препарат берут в большем количестве, чем указано в рецепте, с учетом содержания кристаллизационной воды, по расчету:
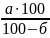
где a - количество безводной глюкозы, указанное в рецепте;
б – процентное содержание воды в препарате по анализу.
5% раствор препарата должен выдерживать испытание на пирогенность; тест-доза 10 мл на 1 кг веса.
Количественное определение глюкозы йодиметрическим методом.
Характеристика метода
В основе йодиметрических методов лежит реакция:
I2 + 2e = 2I-
В титриметрическом анализе используют и окислительные свойства I2 и восстановительные свойства I-.
Методы, основанные на окислении веществ раствором йода, называют йодиметрическими.
Окисление иодид-ионов подходящим окислителем с последующим титрованием выделившегося I2 раствором Na2S2O3 cоставляет йодометрическое титрование.
Титрант метода
Раствор I2
Йод I2 плохо растворим в воде, но хорошо растворим в водных растворах, содержащих 3-4 кратный избыток I- ионов, с которыми образует комплексные ионы I3-.
I2 + I- = I3-
Тогда реакцию титрования можно записать следующим образом:
I3- + 2e = 3I-
Раствор титранта можно приготовить по точной навеске из предварительно очищенного сублимацией йода I2, но растворы I2 не устойчивы, т.к.
I2 летуч;
I2 способен окислять различные органические вещества, которые присутствуют в воде в виде примесей
Возможно окисление I- ионов кислородом воздуха
4I- + O2 + 4H+ = 2I2 + 2H2O
При этом концентрация раствора I2 может увеличиться.
Поэтому стандартизацию титранта проводят всякий раз перед его применением. Чаще всего стандартизируют прямым титрованием аликвоты раствора Na2S2O3 раствором I2, иногда AsO3-.
Хранят раствор в темноте, в склянках из темного стекла.
Раствор Na2S2O3
Раствор готовят из Na2S2O3 · 5H2O.
Точную концентрацию титранта устанавливают через несколько дней после приготовления раствора. При хранении растворы Na2S2O3 изменяют свою концентрацию в результате протекания следующих процессов:
Na2S2O3 реагирует с углекислым газом
В результате образуется близкий тиосульфату по силе восстановитель гидросульфит-ион HSO3-, тогда при титровании раствора I2 одновременно могут протекать два процесса:
2S2O32- + I2 = S4O62- + 2I-
HSO3- + I2 + H2O = HSO4- + 2H+ + 2I-
Поэтому на титрование затрачивается большее количество I2 , что приводит к погрешности анализа. Для стабилизации в раствор вводят Na2CO3.
Na2S2O3 окисляется кислородом воздуха:
2S2O32- + O2 = 2SO42- + 2S
Na2S2O3 разлагается микроорганизмами – тиобактериями, которые всегда находятся в воздухе и легко попадают в раствор. Для стабилизации вводят дезинфицирующие средства (хлорамин) и защищают от прямого солнечного света.
Стандартизируют заместительным титрованием стандартным раствором калий дихромата K2Cr2O7.
Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O
I2 + 2S2O32- = 2I- + S4O62-
Примечание: скорость взаимодействия K2Cr2O7 и I- вблизи точки эквивалентности невелика, поэтому выделившийся I2 оттитровывают только через 5-10 минут.
Непосредственное титрование тиосульфата раствором калий дихромата невозможно из-за нестехиометричности реакции.
Способы фиксирования конечной точки титрования
Безиндикаторный способ
К.т.т. фиксируется по собственной светло желтой окраске избытка титранта I2.
При титровании в среде органического растворителя иод переходит в органическую фазу и окрашивает ее в фиолетовый цвет.
Индикаторный способ
Используют специфический индикатор – крахмал, образующий с I2 соединение интенсивно синего цвета. Чувствительность реакции высока.
Особенность: индикатор добавляют всегда в конце титрования.
Основные условия йодиметрических определений
При низких температурах летучесть йода уменьшается и увеличивается чувствительность йодкрахмальной реакции.
Йодиметрическое титрование проводят только в слабокислой и нейтральной средах. Ограничения связаны с тем, что:
В сильно кислых средах возможно окисление иодид-ионов кислородом воздуха:
4I- + 2O2 + 4H+ = 2I2 + H2O
В щелочных растворах иод диспропорционирует:
I2 +2OH- = IO- + I- +H2O
Образующийся гипоиодид-ион IO- может конкурировать с I2 в реакциях с S2O32-.
Практическое применение йодиметрических определений
Данный метод является универсальным. Применяется для определения восстановителей, окислителей и веществ, не обладающих окислительно-восстановительными свойствами, но способных реагировать с компонентами окислительно-восстановительных систем.
Определение восстановителей
Анализируют восстановители потенциал которых меньше 0,54 В: As (III), Sb (III), SO32-, Sn (II), S2-. Для быстро протекающих реакций применяют прямое титрование.
Пример:
I2 + 2S2O32- = 2I- + S4O62-
E0I2\2I- = 0,54B E0S4O62-\2S2O32- = 0,09В
ЭДС = Е0ок-ля - Е0вос-ля= 0,54 – 0,09 = 0,45В → реакция идет до конца
Кр≈1015
Для медленно протекающих реакций используют обратное титрование. К анализируемому раствору восстановителя добавляют точно известный избыток раствора йода и оставляют на время, достаточное для протекания реакции. Затем непрореагировавшую часть йода оттитровывают раствором натрий тиосульфата:
SO32- + I2 (избыток) + Н2О = SO42- + 2I- + 2H+
I2 (остаток) + 2S2O32- + 2I- + S4O62-
Йодиметрически анализируют многие органические соединения: сахара, спирты, кетоны, азот- и серосодержащие соединения и др. Используют обратное титрование. Окисление органического соединения избытком раствора йода проводят в щелочной среде, после окончания реакции раствор подкисляют и остаток йода оттитровывают тиосульфатом (среда нейтральная).
Пример:
HCOH + I2(избыток) + 2OH- = HCOOH + 2I- + H2O
I2 (остаток) + 2S2O32- = 2I- + S4O62-
Аналогично, анализируют ряд лекарственных веществ: антипирин, аскорбиновую кислоту, анальгин, кофеин, изониазид, метионин.
Определение окислителей
Основано на окислении иодид-иона анализируемым окислителем с последующим титрованием выделившегося йода раствором тиосульфата (заместительное титрование).
Определяют окислители: K2Cr2O7, KMnO4, Na3AsO4, Cu(II), Na2O2, пероксиды, Na+, Ba2+.
Наиболее важная реакция этого типа следующая:
Cr2O72- + 6I- + 14H+ = 2Cr3+ + 2I2 + 7H2O
I2 + 2S2O32- = 2I- + S4O62-
Данную реакцию используют для:
Стандартизации S2O32-
Определения Cr в сталях
Определения катионов, образующих малорастворимые хроматы (Ba2+, Pb2+).
Анализируемый катион осаждают в виде хромата:
Pb2+ + CrO42- = PbCrO4↓
Осадок отделяют и растворяют в кислоте:
2PbCrO4 + 2H+ = 2Pb2+ + Cr2O72- + H2O
Выделившийся дихромат определяют йодиметрически.
Стандартизация раствора йода I2.
Стандартизацию титранта I2 проводим по титрованному раствору натрий тиосульфата.
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Аликвотную часть раствора I2 титруем раствором Na2S2O3 до соломенно-желтой окраски, добавляем крахмал и продолжаем титровать до обесцвечивания. Титрование повторяли 5 раз, рассчитываем средний объем. Молярную концентрацию рассчитываем по формуле.
V1 = 5,6 мл;
V2 = 5,6 мл;
V3 = 5,6 мл;
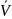 =
5,6 мл.
=
5,6 мл.

Методика определения глюкозы
Берем 5 навесок глюкозы. Используем метод точных навесок.
m1 = 0,087 г.
m2 = 0,098 г.
m3 = 0,099 г.
m4 = 0,097 г.
m5 = 0,088 г.
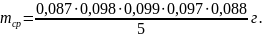
Точную массу (0,08-0,1г) глюкозы m1 растворяют в воде, прибавляют 25 мл раствора I2 (C (1/2 I2) = 0,1моль/л), 50 мл 0,1 моль/л раствора NaOH и оставляют на 10-15 минут. При этом глюкоза окисляется. Основной продукт окисления D-глюконовая кислота, которая при взаимодействии с натрий гидроксидом дает соль. Процесс возможен за счет таутомерного перехода в открытую (альдегидную) форму глюкозы в растворе:
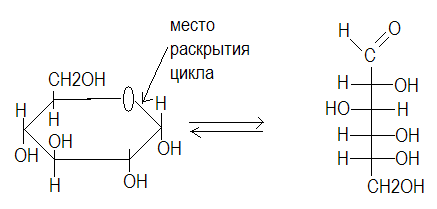
α-D-глюкопираноза D-глюкоза
Процесс окисления:
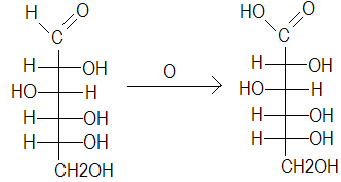
D-глюкоза D-глюконовая кислота
Необходимо помнить, что в щелочной среде моносахариды неустойчивы, поэтому при окислении получается смесь соли D-глюконовой кислоты и других продуктов окисления. В связи с этим рекомендован способ обратного иодиметрического титрования (окисления до D-глюкаровой кислоты, когда и альдегидная и первичная спиртовая группировки одновременно окисляются в карбоксильные группы, также не происходит. Для этого необходим сильный окислитель в нейтральной или кислой среде. Например, разбавленная азотная кислота).
Раствор подкисляют 10 мл раствора Н2SO4 (разб)
Остаток I2 титруют раствором Na2S2O3 (С (Na2S2O3) = 0,1моль/л). Индикатор -крахмал.
Расчеты
Объемы раствора натрий тиосульфата, пошедшие на титрование глюкозы:
V1 = 17,5 мл;
V2 = 18,3 мл;
V3 = 19,0 мл;
V4 = 17,2 мл;
V5 = 19,1 мл.
Формула для расчета массы антипирина в навеске:
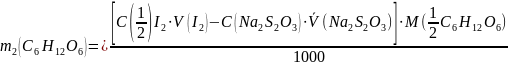
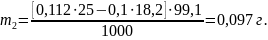
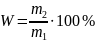
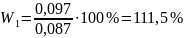
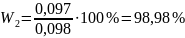
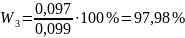
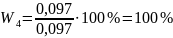
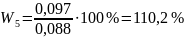
Математическая обработка результатов анализа
Wi, % |
n |
|
|
|
|
|
|
|
|
111,5 |
5 |
103,73 |
-7,77 |
60,4 |
171,9 |
= 6,5 |
= 3,67 |
2,48 |
103,73 ± 10,2
|
98,98 |
4,75 |
22,6 |
|||||||
97,98 |
5,75 |
33,1 |
|||||||
100 |
3,73 |
13,9 |
|||||||
110,2 |
-6,47 |
41,9 |
Вывод: массовая доля глюкозы равна 103,73 ± 10,2 %

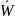 ,
%
,
%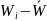
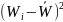
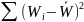
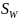
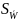
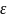
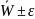
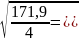
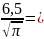
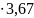 = 10,2
= 10,2