
- •Введение.
- •Вязкость. Классификация и методы определения.
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора .
- •Приготовление нормальных растворов.
- •Приготовление растворов.
- •Исследование свойств волокон в результате действия различных температур
- •Ход работы:
- •Результат испытаний
- •30 Минут:
- •60 Минут:
- •90 Минут:
- •Международная научная конференция
Вязкость. Классификация и методы определения.
Вязкость – это свойство жидкости оказывать сопротивление ее течению под действием сдвига. Величина вязкости может зависеть по крайней мере от шести независимых параметров:
h = f (S, T, P, .g, τ, V)
Классификация вязкостей:
Динамическая вязкость (обозначается h);
- Кинематическая вязкость (обозначается n);
- Условная вязкость;
Относительная вязкость.
Для разбавленных растворов полимеров:
Абсолютная вязкость;
Относительная вязкость;
Приведенная вязкость;
Характеристическая вязкость
Динамическая вязкость.
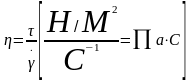 Характеризует
сопротивление которое оказывает среда
при перемещении двух ее слоев площадью
1м2,
отстоящих друг от друга на расстоянии
1м, под влиянием силы в 1H
при U
= 1м/с. Измеряется [Па*с = H*c*м-2].
Характеризует
сопротивление которое оказывает среда
при перемещении двух ее слоев площадью
1м2,
отстоящих друг от друга на расстоянии
1м, под влиянием силы в 1H
при U
= 1м/с. Измеряется [Па*с = H*c*м-2].
Где h - динамическая вязкость; τ - напряженность; .g – скорость сдвига
Кинематическая вязкость.
При измерении вязкости ньютоновской жидкости в капиллярных вискозиметрах типа Уббелоде или Кэннона – Фенске определяется ее кинематическая вязкость. В данном случае образец жидкости течет через капилляр под действием силы тяжести.
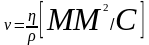 Кинематическая
вязкость n
связана с
динамической вязкостью h
соотношением, в котором плотность
жидкости ρ
является еще одним дополнительным
параметром.
Кинематическая
вязкость n
связана с
динамической вязкостью h
соотношением, в котором плотность
жидкости ρ
является еще одним дополнительным
параметром.
Условная вязкость.
Эта величина, показывающая во сколько раз время истечения жидкости из вискозиметра при Т испытания больше времени истечения дистиллированной воды при 20 oC. Для перевода значений кинематической вязкости в условную, выраженную в градусах, используют специальные таблицы.
(УВ) – отношение вязкости данной жидкости в вязкости воды при той же T.
Относительная вязкость.
Б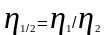 езразмерная
величина, равная отношению динамической
вязкости среды к значению динамической
вязкости другой среды с известным
значением η:
езразмерная
величина, равная отношению динамической
вязкости среды к значению динамической
вязкости другой среды с известным
значением η:
Классификация жидкостей по их реологическому поведению.
Ньютоновские жидкости -вязкие жидкости, подчиняющиеся в своем течении закону вязкого трения Ньютона, то есть касательное напряжение и градиент скорости линейно зависимы. Коэффициент пропорциональности между этими величинами известен как вязкость.
Неньютоновские жидкости-все остальные жидкости, не проявляющие такого «идеально» характера течения жидкости, называют «неньютоновскими жидкостями». Неньютоновских жидкостей значительно больше, чем идеальных жидкостей. Их подразделяют на:
- Псевдопластичные жидкости
- Дилатантные жидкости
- Вязкопластичные .
Классификация вискозиметров:
Ротационные реометры (вискозиметры);
Капиллярный вискозиметры;
Вискозиметр с падающим шаром;
Вибрационные;
Ультразвуковые.
Вискозиметр Штабингера SVM3000 (Anton Paar)

Предназначен для измерения плотности, динамической и конематической вязкости: Нефти, Продуктов нефтехимического синтеза ,Дизельного топлива , Топлив для реактивных двигателей ,Керосина , Битумов ,Угольных смол ,Автомобильных масел ,Масел гидравлических систем, Смазок , Присадок , Антифризов , Парфюмерных масел ,Жиров
Измерение плотности, вязкости и индекса вязкости с помощью SVM3000
Определение кинематической вязкости нефтепродуктов проводится в соответствии с ГОСТом 33-2000 (ISO 3104-94). Основа метода – измерение времени истечения определенного объема жидкости под действием силы тяжести через калиброванный стеклянный капиллярный вискозиметр. ГОСТ. Этот же ГОСТ предусматривает и вычисление по полученным результатам динамической вязкости.
Компания Anton Paar представляет новый прибор SVM3000, который выполняет обратную задачу – рассчитывает кинематическую вязкость из измеренной динамической.
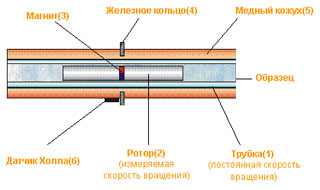
Очень интересен принцип работы прибора, который запатентован его изобретателем – доктором Штабингером, по имени которого и назван вискозиметр.
Трубка (1), которая заполняется образцом, вращается с постоянной угловой скоростью. В образце, как поплавок, находится цилиндрический полый ротор (2), а внутри ротора – постоянный магнит (3). Центрирование ротора происходит за счет железного кольца (4). Вращение трубки (1) приводит к взаимному смещению слоев жидкости и вращению ротора (2). Если бы магнита не было, в состоянии равновесия и внешняя трубка (1) и ротор вращались бы с одинаковой скоростью. Однако, в его присутствии, переменное магнитное поле приводит к появлению вихревых токов в медном корпусе (5). Именно за счет этих токов и происходит торможение ротора. Сила торможения в состоянии установившегося равновесия постоянна и ей препятствует только вязкость жидкости.
Таким образом, измерив разницу скоростей вращения внешней трубки и ротора, можно определить динамическую вязкость. Как определить скорость вращения ротора? Кроме эффекта торможения, переменное поле от внутреннего магнита выполняет ещё одну задачу – действует на датчик Холла (6), который преобразует энергию магнитного поля в потенциал постоянного тока. Итак, основная задача выполнена – разность скоростей внешней трубки и внутреннего ротора измерена, и, следовательно, можно определить значение динамической вязкости.
Преимущества описанного принципа заключаются прежде всего в том, что в такой системе «бесконтактного» тормоза не задействованы трущиеся детали, как в «классических» ротационных вискозиметрах и можно зафиксировать очень малые напряжения сдвига.
Для расчета кинематической вязкости в вискозиметре Штабингера предусмотрена ещё одна ячейка – для измерения плотности осцилляционным методом. Она аналогична конструкции измерительных ячеек плотномеров Anton Paar, которые являются самыми точными на сегодняшний день на рынке аналогичных изделий. Кинематическую вязкость вычисляют как отношение динамической вязкости и плотности.
Важнейшее условие измерения вязкости и плотности – хорошее термостатирование образца. Для этого обе измерительные ячейки окружены каскадом элементов Пельте – так называемым, «сухим» термостатом. Такой термостат может охлаждать образец и поддерживать температуру на 20 °C ниже комнатной, а нагревать до 100 °C. При наличии криостата, который подключается к встроенному в прибор дополнительному термостатирующему контуру, нижний предел температуры может быть снижен до -40 °C.
Термостатирование происходит быстро и с высокой точностью, кроме этого, в вискозиметре Штабингера SVM 3000 предусмотрены несколько температурных программ – измерение вязкости при определенных температурах без вмешательства оператора.

Одна из таких программ - измерение вязкости в двух температурных точках
+40 °C
+100 °C
и расчет индекса вязкости (VI) в соответствии с ASTM D2270.
Важный вопрос при использовании вискозиметра Штабингера – количество измерений в единицу времени. Этот параметр варьируется от 15 до 20 образцов в час в зависимости от необходимости промывки и сложности образца, а для измерений индекса вязкости масел – около 3-х образца в час.
Все четыре параметра – кинематическая и динамическая вязкость, плотность, температура – выводятся на дисплей прибора или на принтер в полном соответствии с международными нормами GLP. При использовании температурной программы индекса вязкости, на дисплей выводится только его расчетное значение, а на принтер — все параметры, измеренные в каждой температурной точке.
Преимущества вискозиметра Штабингера SVM3000 очевидны:
нет необходимости использовать стеклянные капилляры, которые могут быть по неосторожности разбиты
сокращается время термостатирования образца за счет его малого объема - вместо 30...60 минут до 5...7 минут
с одним прибором можно измерять как прозрачные, так и непрозрачные жидкости, тогда как при использовании стеклянных капилляров, их тип необходимо менять
промывка прибора менее трудоемка, чем промывка стеклянного капилляра
пользователь одновременно измеряет вязкость и плотность образца, кроме этого, имеется возможность использования измерительных ячеек раздельно – в этом случае для измерения требуется всего 1.5 мл жидкости
при измерении жидкостей с низкой вязкостью нет необходимости определения поправки на кинетическую энергию
нет необходимости поверять каждый стеклянный капилляр – поверяется один прибор для всего диапазона измерения от 0.2 до 104 мм2/с
экономия места в лаборатории – прибор очень компактен и при обычных условиях не требует использования объемных циркуляционных термостатов
Испытания вискозиметра SVM 3000 проводились на базе ВНИИМ им. Д.И. Менделеева, где были подтверждены заявленные производителем характеристики.
Основные технические характеристики
Диапазон измерения динамическая вязкость, мПа*с 0,2...104
кинематическая вязкость, мм2/с 0,2...104
плотность, кг/м3 650...2000
Пределы допускаемой относительной погрешности измерения вязкости, % ±0,35
Пределы допускаемой абсолютной погрешности измерения плотность, кг/м3 ±0,5
температура, °C ±0,02
Условия эксплуатации диапазон температуры окружающей среды, °C 5...35
диапазон относительной влажности, % 10...90, без конденсации
Диапазон рабочих температур, °C 0...100 (от -40...100 при подключении дополнительного охладителя)
Объем образца (только для измерения динамической вязкости), мл, не менее 1,5
Объем образца (для измерения плотности и вязкости), мл, не менее 3,0
Способы выражения концентрации растворов и примеры решения.
Концентрация – величина, характеризующая количественный состав раствора. Концентрацию веществ в растворах можно выразить разными способами.
Массовая доля растворённого вещества W(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
W(B)= m(B) / m
Массовую долю растворённого вещества W(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример: Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение: m(Na2SO4) = w(Na2SO4) / 100 = (5 · 300) / 100 = 15 г
где w(Na2SO4)) – массовая доля в %, m - масса раствора в г m(H2O) = 300 г - 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4) и 285 г воды
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример: Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение: M(K2CrO4) = C(K2CrO4) · V · M(K2CrO4) = 0,1 моль/л · 1,2 л · 194 г/моль » 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд Пример: Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример: Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение: Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 · 1000 / 61,92 = 1130,49 г H2SO4 Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
