
- •Оглавление
- •Список основных сокращений
- •Введение
- •Глава 1. Структура и функции системы иммунитета
- •Виды иммунитета
- •Цитокины и интерлейкины
- •Поверхностные лейкоцитарные антигены и рецепторы
- •Гуморальные факторы врожденного иммунитета
- •Клетки естественного врожденного иммунитета
- •Лимфоидная система
- •Иммуноглобулины и антитела
- •Р ис. 1.3. Этапы развития клеток, принимающих участие в иммунном ответе
- •Глава 2. Антигены. Динамика иммунного ответа Антигены
- •Динамика иммунного ответа
- •Глава 3. Иммунитет и инфекции
- •Противобактериальный иммунитет
- •Противовирусный иммунитет
- •Противопаразитарный и противогрибковый иммунитет
- •Глава 4. Виды иммунопатологии
- •Иммунодефицитные болезни
- •Аллергия и аутоиммунные заболевания
- •I тип реакций. Анафилактические реакции (реагиновые, IgE- зависимые).
- •Анафилактический шок, приступ бронхиальной астмы, ринит, отек Квинке, крапивница Эозинофилы
- •II тип. Цитотоксические реакции.
- •III тип. Иммунокомплексные реакции.
- •Трансплантационный иммунитет
- •Противоопухолевый иммунитет
- •Глава 5. Иммунодиагностика. Оценка иммунного статуса
- •Специфические показатели иммунного статуса
- •Оценка реакции
- •Глава 6. Иммунотерапия и иммунопрофилактика
- •Противоинфекционные вакцины
- •Серотерапия. Иммунные антисыворотки и иммуноглобулины
- •IV. Природные, синтетические, генно-инженерные препараты:
- •Литература
- •Основы ИммуноЛогии Учебное пособие
- •210602, Витебск, пр. Фрунзе, 27
Р ис. 1.3. Этапы развития клеток, принимающих участие в иммунном ответе
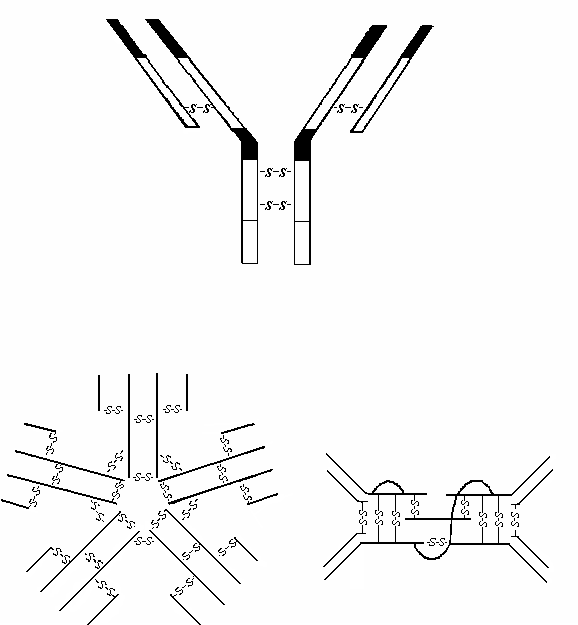
В цепях молекулы иммуноглобулинов различают константные (constant) и вариабельные (variable) участки.
Отдельные замкнутые в виде глобул части цепей иммуноглобулина получили название доменов. В константном участке различают CL, СН1, СН2 и СН3 домены, а в IgM и IgE и СН4 домены, в V-участке – VH и VL домены (в зависимости от цепи).
Гипервариабельные участки, где часты замены аминокислот, относятся к регионам, определяющим комплементарность иммуноглобулиновых молекул. Эти регионы локализованы в доменах тяжелой (VH) и легкой (VL) цепей. Они формируют активный центр молекулы иммуноглобулина (антитела).
Между СН1 и СН2 доменами тяжелой цепи локализуется подвижный – "шарнирный" участок молекулы иммуноглобулина, чувствительный к протеолитическим ферментам (папаину, пепсину, трипсину). Под действием папаина молекула иммуноглобулина расщепляется на 2 Fab-фрагмента (fragment antigen binding – фрагмент, связывающий антиген) и Fc-фрагмент (fragment crystallizable – фрагмент кристаллизующийся).
Когда молекула Ig связывает антиген, CН2 домен Fc-фрагмента иммуноглобулина активирует комплемент по классическому пути, а СH3 домен может связываться с Fc-рецепторами, имеющимися на лейкоцитах и других клетках.
Иммуноглобулины класса G составляют основную массу иммуноглобулинов сыворотки крови (75-85%) – 10 г/л (8-12 г/л). Они неоднородны по строению Fс-фрагмента и различают их четыре субкласса: G1, G2, G3, G4.
Снижение уровня IgG в крови обозначается как гипогаммаглобулинемия IgG, увеличение – гипергаммаглобулинемия IgG.
Основную массу антител против бактерий, их токсинов и вирусов составляют IgG.
Иммуноглобулины класса М (м.м. 950 кДа) содержатся в сыворотке крови в концентрации от 0.8 до 1.5 г/л, в среднем – 1 г/л. В крови они находятся в виде пентамеров. Антитела IgM синтезируются в организме при первичном иммунном ответе, низкоаффинны, но высокоавидны из-за большого числа активных центров.
Иммуноглобулины класса А (от 1,5 до 3 г/л) IgA в крови присутствуют в виде мономеров, а в секретах в форме димеров и тримеров. Секреторные IgA (sIgA), будучи антителами, формируют местный иммунитет, препятствуют адгезии микроорганизмов к эпителию слизистых оболочек, опсонируют микробные клетки, усиливают фагоцитоз.
Иммуноглобулины класса D содержатся в сыворотке крови в концентрации 0,03-0,04 г/л. Они служат рецепторами созревающих В-лимфоцитов.
Иммуноглобулины класса Е присутствуют в сыворотке крови в концентрации около 0,00005 г/л или от 0 до 100 МЕ/мл (1 МЕ ~ 2,4 нг). При аллергии их содержание в крови увеличивается и многие из них специфичны к аллергену, т.е. являются антителами.
Тяжелая цепь
VH
VL
Вариабельные
области

Легкая
цепь (L)
Fab-фрагмент
шарнир
CH2
постоянные
области тяжелой цепи
CH3
Fc-фрагмент
IgG
Рис. 1.4. Структура молекулы иммуноглобулина G
Различают естественные и иммунные антитела. Естественные АТ находятся в организме без предварительного введения антигена (иммунизации). Примером таких АТ являются - и -изогемагглютинины сыворотки крови человека I группы, направленные против А и В антигенов эритроцитов людей других групп крови (II-IV) – это чаще антитела класса IgM. Встречаются естественные антитела против микробов.
Иммунные АТ накапливаются и выявляются в сыворотке крови после предварительной иммунизации антигенами.
Механизм действия антител:
нейтрализация активных центров токсинов (токсиннейтрализующий эффект);
образование комплекса антиген-антитело, который активирует комплемент с последующим лизисом клетки (литический эффект при участии комплемента);
опсонизация объектов фагоцитоза (усиление фагоцитоза);
связывание с Fc-рецепторами лейкоцитов, которые приобретают способность специфично взаимодействовать с антигенами ("вооружающий" эффект антител);
антирецепторные антитела, связываясь с соответствующим рецептором, блокируют его или стимулируют функцию клетки (блокирующие и стимулирующие эффекты);
антитела обладают собственной медленной ферментативной активностью и могут расщеплять некоторые субстраты (абзимная активность).
Бивалентные АТ (обычно класса G), имеющие 2 активных центра, получили название полных АТ. Наряду с ними существуют моновалентные неполные АТ, у которых действует один связывающий активный центр из-за пространственной блокировки второго центра.
Сила связывания (сродство) одного активного центра АТ с эпитопом антигена получила название аффинности (аффинитета). Прочность связывания всей иммуноглобулиновой молекулы с антигеном называется авидностью (авидитетом). Обычно она прогрессивно увеличивается с увеличением количества активных центров в иммуноглобулиновой молекуле. Отсюда наибольшей авидностью обладают IgM.
При иммунизации антигеном в сыворотке крови появляется широкий спектр АТ с различной аффинностью. Это обусловлено тем, что антиген стимулирует большое количество клонов В-клеток. Получаемые таким образом поликлональные иммунные антитела и сыворотки представляют смесь иммуноглобулиновых молекул различных классов.
Иммунные комплексы образуются при взаимодействии активных центров (паратопов) антител и детерминант (эпитопов) антигенов в нейтральной среде (рН 7,2-7,3) за счет связей Ван-дер-Ваальса (нековалентная связь – наименьший энергетически выгодный радиус между атомами), водородных (атомы водорода в составе функциональных групп), электростатических и гидрофобных.
Взаимодействия антител и антигенов вызывают феномены агглютинации, преципитации и лизиса. Иммунные комплексы активируют комплемент по классическому пути, связывая его С1q компонент СН2 доменом Fc-фрагмента IgG или IgM. Если эти Ig-антитела направлены против антигенов мембраны клетки, то она при этом лизируется (см. «комплемент»).
Моноклональные антитела
Моноклональные антитела разработаны на основе соматической гибридомной технологии. Такие АТ моноспецифичны, направлены к одному эпитопу АГ.
Для их получения мышей иммунизируют изучаемым антигеном (в клеточной или растворимой форме). Из селезенки иммунизированных животных получают суспензию клеток, среди которых есть антителообразующие. Затем проводят слияние этих антителообразующих В-клеток, срок жизни которых невелик, с В-клетками мышиной опухоли – плазмоцитомы (делятся непрерывно, «бессмертные» клетки). Сама плазмоцитома к синтезу АТ не способна. Слияние геномов этих клеток под одной клеточной мембраной (с помощью полиэтиленгликоля) приводит к появлению гибридных клеток. Они приобретают способность к синтезу специфических антител (от иммунных В-лимфоцитов) и становятся долгоживущими, непрерывно делящимися (как плазмоцитома). Чтобы их выявить, взвесь клеток культивируют в специальной среде, в которой не растут обычные негибридные клетки.
Из выращенной смеси гибридных клеток выделяют по 1 клетке и помещают в одну лунку с жидкой питательной средой и размножают (клонируют). После роста клонов в их надосадочной жидкости ищут антитела к изучаемому антигену. После их обнаружения, в одной из лунок, соответствующий клон отбирают и размножают. Накопившийся клон клеток продуцирует моноклональные АТ специфичные к единственному эпитопу изучаемого антигена.
Моноклональные АТ оказались исключительно удобным диагностическим средством. С их помощью выявляют антигены бактерии и вирусов, маркеры клеточных популяций, гормоны, медиаторы и т.д.
В настоящее время их все шире используют для лечения (пример – препарат инфликсимаб – моноклональные АТ, блокирующие действие ФНО и тем самым подавляющие местное и системное воспаление).
Т-лимфоциты
После поступления в тимус (вилочковую железу) происходит антигеннезависимая дифференцировка Т-клеток под влиянием гормонов тимуса ( и -тимозины, тимулин, тимопоэтин). Здесь Т-лимфоциты дифференцируются в иммунокомпетентные клетки и приобретают способность к распознаванию антигена.
Основные молекулы-маркеры, присутствующие на поверхности Т-лимфоцитов: CD2 (один эпитоп-рецептор к эритроцитам барана), СD3, СD4 (у Т-хелперов), СD8 (у Т-цитотоксических (Тц)).
В норме у человека Т-лимфоциты составляют 60% (50-75%) всех лимфоцитов крови.
Т-лимфоциты неоднородны по функциям. Различают следующие основные их субпопуляции: Т0 (нулевые, тимические, «наивные», незрелые), Т-хелперы, Т-супрессоры и Т-клетки памяти (см. рис. 1.1).
Т-хелперы (Тх) стимулируют пролиферацию и дифференцировку Т- и В-лимфоцитов, выделяя интерлейкины. На поверхности Т-хелперов имеются те же маркеры, что и на остальных Т-лимфоцитах (СD2, СD3), а также свойственная им СD4-молекула адгезии, которая участвует как вспомогательная при взаимодействии с антигеном Т-клеточного рецептора (см. ниже), служит рецептором к ВИЧ-вирусу и к молекулам главного комплекса гистосовместимости II класса (МНС-II) других клеток. В норме у человека Тx составляют 34-45% лимфоцитов крови. Среди них различают Тx первого типа (Тx1) , выделяющие ИЛ-2, -интерферон и другие, и в итоге обеспечивающие реакции Т-клеточного иммунитета; Тx второго типа (Тx2), секретирующие ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-13 и стимулирующие синтез антител.
Тх 3-регуляторная субпопуляция (фенотип CD4+ CD25+) при активации синтезирует ИЛ-10 и TGF (трансформирующий фактор роста ). Синтез этих цитокинов и продукта гена Foxр4+ – белка скурфина ассоциирован с супрессией иммунного ответа.
Т-цитотоксическими называют те Т-лимфоциты (18-22% в крови), которые несут антиген СD8 и рецептор к IgG (Fc). Макромолекула CD8 служит рецептором для антигенов главного комплекса гистосовместимости I класса (МНС-I). После активации антигеном Т-супрессоры/цитотоксические клетки – Т-киллеры связываются с ним на поверхности клеток и, выделяя цитотоксин (белок перфорин), разрушают их. При этом Т-киллер остается жизнеспособным и может разрушать следующую клетку.
Т-клеточный рецептор
На поверхности Т-лимфоцитов имеется около 3х104 прочно связанных с мембранами Т-клеточных рецепторов (ТКР) к антигену, чем-то напоминающих антитела. Т-клеточный рецептор является гетеродимером и состоит из альфа- и бета- (молекулярная масса 40-50 кDа) и, реже, из /-цепей (1-5%-клеток в крови).
У Тх и Тц ТКР одинаковы по строению. Однако Т-хелперы взаимодействуют с антигеном, ассоциированным с HLA-молекулами II класса, а Т-цитотоксические распознают антиген в комплексе с HLA-молекулами I класса. Причем белковый антиген должен быть переварен антигенпредставляющими клетками и представлен в виде пептида длиной 8-11 аминокислот для Т-цитотоксических и 12-25 для Т-хелперов. Такое различие в связывании Тх и Тс пептидов обусловлено участием во взаимодействии молекул – CD4 у Тх и CD8 у Тц.
