
5) Оксигенази – ферменти, які каталізують пряме введення кисню в молекулу субстрату.
Оксигенази не належать до ферментів, що каталізують реакції, які збагачують клітину енергією; вони беруть участь у синтезі і розкладі багатьох типів метаболітів. Ферменти цієї групи каталізують включення кисню в молекулу субстрату.
Воно відбувається в дві стадії: 1) кисень зв'язується з активним центром ферменту; 2) відбувається реакція, у результаті якої зв'язаний кисень відновлюється чи переноситься на субстрат. Оксигенази діляться на дві підгрупи.
а) Діоксігенази (кисень-трансферази, істинні оксигенази). Ці ферменти каталізують включення в молекулу субстрату обох атомів молекули кисню:
А + О2 ® АО2.
Приклад – залізовмісні ферменти гомогентизатдіоксігеназа і 3-гідроксиантранілат-діоксігеназа із супернатантної фракції гомогенату печінки, а також гемвмісні ферменти, зокрема L-триптофандіоксігеназа (триптофанпіролаза) з печінки.
б) Монооксигенази (оксидази зі змішаною функцією, гідроксилази). Ці ферменти каталізують включення в субстрат тільки одного з атомів молекули кисню. Інший атом кисню відновлюється до води; для цього необхідний додатковий донор електронів (косубстрат):
А–Н + О2 + ZH2 ® А–ОН + Н2О + Z
Мікросомні цитохром Р450-вмісні монооксигеназні системи. До цієї групи належать ферменти, які беруть участь у метаболізмі багатьох лікарських речовин шляхом їх гідроксилювання. Вони знаходяться в мікросомах печінки разом з цитохромом Р450 і цитохромом b5. Відновниками цих цитохромів є НАДН і НАДФН (рис. 3); цитохроми окислюються субстратами в результаті серії ферментативних реакцій, які складають так званий гідроксилазний цикл (рис. 4):
Лік–Н
+ О2
+ 2Fe2+(P450)
+ Н+
![]() Лік–ОН + Н2О
+ 2Fe3+
Лік–ОН + Н2О
+ 2Fe3+
(Лік – лікарська речовина).
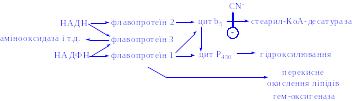
Рис 3. Ланцюг транспорту електронів в мікросомах.
Ціанід (CN-) гальмує стадію, вказану на рисунку.
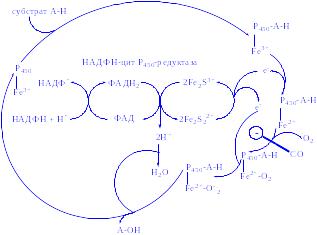
Рис 4. Цитохром Р450-гідроксилазний цикл у мікросомах.
До лікарських речовин, метаболізм яких відбувається за участю розглянутих систем, відносяться: бенз[a]пірен, амінопірин, анілін, морфін і бензофетамін. Багато лікарських речовин, наприклад фенобарбітал, здатний індукувати синтез мікросомних ферментів і цитохрому Р450.
Мітохондріальні цитохром Р450-вмісні монооксигеназні системи. Ці системи знаходяться в стероїдогенних тканинах – у корі наднирників, у сім’яниках, яєчниках і плаценті; вони беруть участь у біосинтезі стероїдних гормонів з холестеролу (гідроксилювання по С22 і С20 при відщепленні бічного ланцюга і по положеннях 11b і 18). Ферменти ниркової системи каталізують гідроксилювання 25-гідроксихолекальциферолу по положеннях 1a і 24; у печінці відбувається гідроксилювання холестеролу по положенню 26 при біосинтезі жовчних кислот. У корі наднирників вміст мітохондріального цитохрома Р450 у шість разів вище, ніж вміст цитохромів дихального ланцюга. Монооксигеназна система складається з трьох компонентів, локалізованих у внутрішній мітохондріальній мембрані на границі з матриксом: НАДФ-специфічного ФАД-вмісного флавопротеїну, Fе2S2-білка (адренодоксину) і цитохрома Р450 (рис. 5).
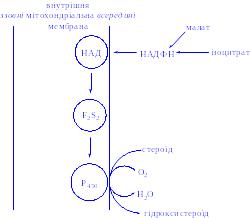
Рис 5. Мітохондріальна цитохром Р450-монооксигеназна система.
Наведена система типова для гідроксилаз стероїдів у корі наднирників. Мікросомна цитохром Р450-гідроксилаза печінки не має потреби в присутності залізо-сірчаного білка Fe2S2. Оксид вуглецю (СО) гальмує зазначену на рисунку стадію.
Fe2S2 – залізо-сірчаний білок (адренодоксин). Оскільки НАДФ(H) не може проникати в мітохондріальну мембрану, джерелами відновних еквівалентів є такі субстрати, як малат і ізоцитрат, для яких усередині мітохондрій є специфічні НАДФ-залежні дегідрогенази.
Метаболізм супероксид-радикала. Кисень є потенційно токсичною речовиною. Донедавна його токсичність пов'язували з утворенням Н2О2. Однак останнім часом, приймаючи на увагу, по-перше, ту обставину, що кисень у тканинах легко відновлюється в супероксидний аніон-радикал (O2-.), і, по-друге, наявність в аеробних організмів супероксиддисмутази (СОД) (її немає в облігатних анаеробів), було висунуто припущення про те, що токсичність кисню обумовлена його перетворенням у супероксид. Однак прямих даних про токсичність супероксид-радикала поки не отримано.
Супероксид утворюється в ході одноелектронного окислення молекулярним киснем відновленого флавіну, наприклад флавіну в складі ксантиндегідрогенази. Він утворюється також при одноелектронному окисленні молекулярним киснем відновленого компонента дихального ланцюга:
Enz–H2 + O2 ® Enz–H + O2-. + H+.
Супероксид може відновлювати окислений цитохром с:
О2-. + Цит с (Fе3+) ® О2 + Цит с (Fе2+).
Він відщеплюється також специфічним ферментом – супероксиддисмутазою:
О2-.
+ О2-.
+ 2Н+
![]() Н2О2
+ О2
Н2О2
+ О2
У цій реакції супероксид виступає одночасно як окислювач, так відновник. Хімічна дія супероксиду в тканинах підсилюється в результаті ініціювання ланцюгової реакції утворення вільних радикалів. Було висловлено припущення, що О2-., зв'язаний з цитохромом Р450, є інтермедіатом при активації кисню в процесі реакцій гідроксилювання (рис 4).
Функцією супероксиддисмутази є, очевидно, захист аеробних організмів від ушкоджуючої дії супероксиду. Фермент виявляється в декількох внутрішньоклітинних кампартментах. Цитозольний фермент складається з двох подібних субодиниць, які містять по одному іонові Сu2+ і Zn2+; мітохондріальний фермент, так само як і фермент, виявлений у бактерій, містить іон Мn2+. Ця обставина служить ще одним доказом на користь гіпотези про походження мітохондрій із прокаріот, що вступили в симбіоз із протоеукаріотами. Дисмутаза присутня у всіх основних тканинах аеробів. Перебування тварин в атмосфері 100%-ного кисню викликає адаптивне підвищення вмісту дисмутази, особливо в легенях; тривале перебування в такій атмосфері призводить до ушкодження легень і летальному результату. Антиоксиданти, наприклад a-токоферол (вітамін Е), здатні вловлювати вільні радикали, такі, як О2-., знижуючи тим самим токсичність кисню.
