
Стандартні потенціали деяких окисно-відновних систем
Система |
Е’0, вольт |
Кисень / вода |
+ 0,82 |
Цитохром a: Fe3+ / Fe2+ |
+ 0,29 |
Цитохром с: Fe3+ / Fe2+ |
+ 0,22 |
Убіхінон: окислений / відновлений |
+ 0,10 |
Цитохром b: Fe3+ / Fe2- |
+ 0,08 |
Фумарат / сукцинат |
+ 0,03 |
Флавопротеїн («жовтий фермент»): окислений / відновлений |
– 0,12 |
Оксалоацетат / малат |
– 0,17 |
Піруват / лактат |
– 0,19 |
Ацетоацетат / b-гідроксибутират |
– 0,27 |
Ліпоат: окислений / відновлений |
– 0,29 |
НАД+ / НАДН |
– 0,32 |
Н+ / Н2 |
– 0,42 |
Сукцинат / a-кетоглутарат |
– 0,67 |
Ферменти і коферменти, які приймають участь в окисно-відновних процесах. Ферменти, які каталізують окисно-відновні процеси, називаються оксидоредуктазами. Їх ділять на 5 груп.
1) Оксидази. Істинні оксидази каталізують видалення водню із субстрату, використовують як акцептор тільки кисень. Вони обов’язково містять мідь, продуктом реакції є вода (виключення складають реакції, які каталізуються уриказою і монооксидазою, в результаті яких утворюється Н2О2 ):
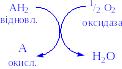
Цитохромоксидаза – гемопротеїн, широко розповсюджений в рослинних і тваринних тканинах. Вона служить кінцевим компонентом ланцюга дихальних переносників, локалізованих в мітохондріях, і каталізує реакцію, в результаті якої електрони, вивільняються із молекул субстрату при їх окисленні дегідрогеназами, переносяться на кінцевий акцептор – кисень. Даний фермент отруюється оксидом вуглецю, ціанідом сірководнем. Інколи цитохромоксидазу називають цитохромом аа3. Спочатку припускали, що цитохром а і цитохром а3 – це автономні гемопротеїни, оскільки кожний з них характеризується визначеним спектром, крім того, вони виявляють різну чутливість до дії оксиду вуглецю і ціаніду. Однак було доведено, що вони входять до складу комплексу, який одержав назву цитохром аа3. Він містить дві молекули гема, у кожній з який атом заліза може переходити зі стану Fe2+ у стан Fe3+ і назад у ході окислення і відновлення, а також два атоми Сu, кожний з яких взаємодіє з одним з гемів.
Фенолаза (тирозиназа, поліфенолоксидаза, катехолоксидаза) – це мідьвмісний фермент із широкою специфічністю. Він каталізує перетворення монофенолу (у присутності о-дифенолу) у о-хінон. Мідь виявлена в ряді інших ферментів, зокрема в уриказі, яка каталізує окислення сечової кислоти в алантоїн, і в моноамінооксидазі, яка окислює адреналін і тирамін у мітохондріях.
2) Аеробні дегідрогенази – ферменти, які каталізують видалення водню із субстрату; на відміну від оксидаз вони як акцептор водню можуть використовувати не тільки кисень, а і штучні акцептори, такі, як метиленовий синій. Ці дегідрогенази відносяться до флавопротеїнів, і продуктом реакції, яку вони каталізують є пероксид водню, а не вода:
 ,
,
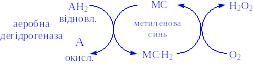
Аеробні дегідрогенази – флавопротеїни; містять простетичні групи – флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД).
До ферментів групи аеробних дегідрогеназ відноситься дегідрогеназа L-амінокислот (оксидаза L-амінокислот) ФМН-вмісний фермент, який знаходиться в нирках і володіє широкою специфічністю, каталізує окисне дезамінування природних L-амінокислот. Широко поширена ксантиндегідрогеназа (ксантиноксидаза); вона виявлена в молоці, у тонкому кишечнику, нирках і печінці.
Ксантиндегідрогеназа містить молібден; відіграє важливу роль у перетворенні пуринових основ у сечову кислоту в печінці і нирках. Особливе значення має для птахів, які екскретують сечову кислоту як головний кінцевий азотовмісний продукт метаболізму пуринів, а також катаболізму білків і амінокислот.
Альдегіддегідрогеназа – ФАД-вмісний фермент, що знаходиться в печінці. Це – металофлавопротеїн – містить молібден і негемове залізо, окислює альдегіди і N-гетероциклічні субстрати.
Глюкозооксидаза – ФАД-специфічний фермент, який одержують із грибів. Вона важлива тим, що використовується при визначенні глюкози.
Механізм окислення і відновлення, що здійснюється цими ферментами, дуже складний. Судячи з наявних даних, відбувається двостадійне відновлення ізоаллоксазонового кільця з проміжним утворенням семіхінона (вільного радикала):
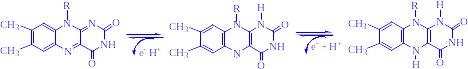
3) Анаеробні дегідрогенази – ферменти, які каталізують видалення водню із субстрату, але не здатні використовувати кисень як акцептор водню. До цього класу належить велике число ферментів. Вони виконують дві функції:
а) перенесення водню з одного субстрату на інший в спряженій окисно-відновній реакції:
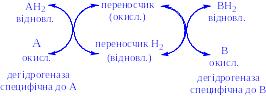
Ці дегідрогенази специфічні до субстратів, але часто використовують один і той же кофермент або переносник водню. Оскільки реакції, які розглядаються оборотні, то вони забезпечують у клітині вільне перенесення відновних еквівалентів. Реакції цього типу призводять до окислення одного субстрату за рахунок відновлення іншого, особливо важливі для здійснення окисних процесів за відсутності кисню.
б) функцію компонентів дихального ланцюга забезпечуючи транспорт електронів від субстрату на кисень:

Поділяються на:
Дегідрогенази, залежні від нікотинамідних коферментів. До цієї категорії належить багато дегідрогеназ. Вони специфічні або до нікотинамідаденіндинуклеотиду (НАД+), або до нікотинамідаденіндинуклеотидфосфату (НАДФ+), які виконують роль коферментів (рис. 1). НАД+ і НАДФ+ утворюються в організмі людини з вітаміну В5. Для синтезу НАД+ чи НАДФ+ ферменти, які знаходяться в цитозолі більшості клітин, використовують тільки нікотинову кислоту, але не нікотинамід. Нікотинамідний фрагмент НАД+ утворюється з нікотинатного фрагмента, коли останній знаходиться в складі нуклеотиду; амідна група надходить від глутаміну (рис. 1).
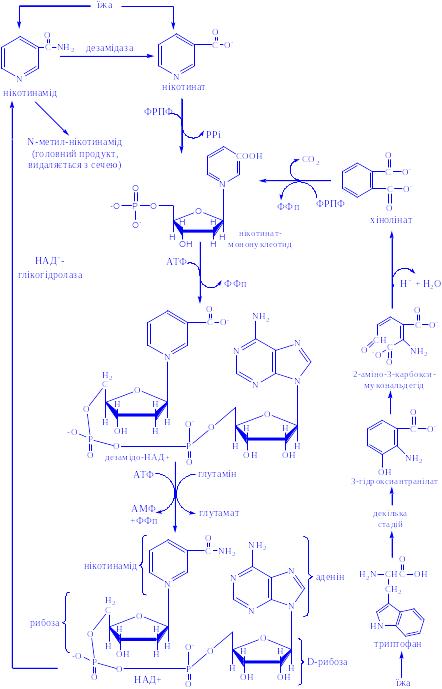
Рис 1. Синтез і розклад нікотинамідаденіндинуклеотиду (НАД).
Є дані про те, що в мітохондріях для синтезу НАД+ використовується нікотинамід. Коферменти відновлюються специфічними субстратами дегідрогеназ і окислюються адекватним акцептором електронів (рис. 2).
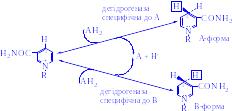
НАД+ + AH2 D НАДH + H+ + A
Рис 2. Механізм окислення і відновлення нікотинамідних коферментів.
У загальному випадку НАД-залежні дегідрогенази каталізують окисно-відновні реакції окисних шляхів метаболізму – гліколізу, циклу лимонної кислоти, дихального ланцюга мітохондрій. НАДФ-залежні дегідрогенази беруть участь у процесах відновного синтезу, зокрема у позамітохондріальному синтезі жирних кислот і стероїдів; вони також є коферментами дегідрогеназ пентозофосфатного шляху. Деякі дегідрогенази, які функціонують з нікотинамідними коферментами, містять іон цинку, зокрема алкогольдегідрогеназа печінки і гліцеральдегід-3-фосфатдегідрогеназа скелетних м'язів. Припускають, що іони цинку не беруть участь безпосередньо в процесах окислення і відновлення.
Рибофлавінзалежні дегідрогенази. Флавінові групи цих дегідрогеназ ті ж, що й в аеробних дегідрогеназ, ФМН і ФАД. Більшість рибофлавін-залежних анаеробних дегідрогеназ або бере участь у транспорті електронів по дихальному ланцюзі, або поставляє електрони для цього ланцюга. НАДФ-дегідрогеназа – компонент дихального ланцюга, яка переносить електрони від НАДН до більш електропозитивних компонентів. Інші дегідрогенази, наприклад сукцинатдегідрогеназа, ацил-СоА-дегідрогеназа і мітохондріальна гліцерол-3-фосфат-дегідрогеназа переносять відновні еквіваленти від субстрату безпосередньо на дихальний ланцюг. Ще одна функція флавін-залежних дегідрогеназ – каталіз дигідроліпоїл-дегідрогеназою дегідрування відновленого ліпоату (інтермедіату при окисному декарбоксилуванні пірувату й a-кетоглутарату). У цьому випадку внаслідок низького значення окисно-відновного потенціалу системи ліпоату переносником водню від відновленого ліпоату до НАД+ є флавопротеїн (ФАД). Електрон-переносний флавопротеїн є проміжним переносником електронів між ацил-СоА-дегідрогеназою і дихальним ланцюгом.
в) Цитохроми. За винятком розглянутої вище цитохромоксидази, цитохроми класифікуються як анаеробні дегідрогенази. Їх ідентифікація і вивчення полегшуються тією обставиною, що у відновленому стані вони мають характерні смуги в спектрі поглинання, які зникають при окисленні. У дихальному ланцюзі вони служать переносниками електронів від флавопротеїнів до цитохромоксидази. Цитохроми є залізовмісними гемопротеїнами, у яких атом заліза переходить зі стану Fe2+ у Fe3+ і назад у процесі окислення і відновлення. До складу дихального ланцюга входять цитохроми b, с1, с, а і а3 (цитохромоксидаза). З них розчинним є тільки цитохром с. Крім дихального ланцюга цитохроми містяться в ендоплазматичному ретикулумі (цитохроми Р450 і b5), у рослинних клітинах, бактеріях і дріжджах.
Відновлення нікотинаміду субстратом (АН2) по положенню 4 відбувається стереоспецифічно. Один з атомів водню переноситься від субстрату в положення 4 у виді ядра водню з двома електронами (гідрид-іон, Н- ): він може приєднатися або в А-, або у В-положенні в залежності від специфічності дегідрогенази, яка каталізує дану реакції. Інший водень, який відщеплюється від субстрату, залишається вільним у виді іона водню.
4) Гідроксипероксидази – ферменти, які використовують як акцептор перекис водню або органічні перекиси. До цієї категорії відносяться два типи ферментів: пероксидази, які знаходяться в складі молока, в рослинах, лейкоцитах, тромбоцитах, еритроцитах і т.д., і каталаза, яка функціонує в тканинах тварин і рослин.
Пероксидаза. Спочатку пероксидази вважалися рослинними ферментами, пізніше вони були виявлені також у молоці, лейкоцитах, тромбоцитах, а також у тканинах, у яких відбувається метаболізм ейкозаноїдів. Простетичною групою є протогем, який на відміну від гемових груп більшості гемопротеїнів дуже слабко зв'язаний з апоферментом. У реакції, яку каталізує пероксидаза, перекис водню відновлюється за рахунок сполук, що виступають як донори електронів, таких, як аскорбат, хінони чи цитохром с. Реакція, яку каталізує пероксидаза, має складний характер; сумарна реакція виглядає в такий спосіб:
Н2О2
+ АН2
![]() 2Н2О
+ А
2Н2О
+ А
В еритроцитах глутатіонпероксидаза, яка містить як простетичну групу – селен, каталізує розклад Н2О2 і гідроперекисів ліпідів відновленим глутатіоном і в такий спосіб захищає ліпіди мембран і гемоглобін від окислення перекисами.
Каталаза. Гемопротеїн, який містить чотири гемові групи. Поряд з пероксидазною активністю каталаза здатна використовувати одну молекулу Н2О2 як донор електронів, а іншу – як окислювач, тобто акцептор електронів. In vivo у більшості випадків каталаза розкладає пероксид водню:
2Н2О2
![]() 2Н2О
+ О2
2Н2О
+ О2
Каталаза міститься у крові, кістковому мозку, мембранах слизових оболонок, нирках і печінці. Її функція – розкладання перекису водню, що утворюється при дії аеробних дегідрогеназ. У багатьох тканинах, включаючи і печінку, виявлені мікротільця, пероксисоми, які багаті аеробними дегідрогеназами і каталазою. Очевидно, біологічно вигідно групувати як ферменти, що призводять до утворення Н2О2, так і ферменти, що розкладають його в одному місці:
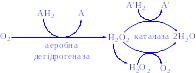
До ферментів, що забезпечують утворення Н2О2, крім пероксисомних ферментів відносяться також мітохондріальні і мікросомні системи транспорту електронів.
