
5. Ізомерази
Ці ферменти каталізують реакції внутрішньомолекулярного переміщення різних груп органічних речовин. Складаються з п’яти підкласів.
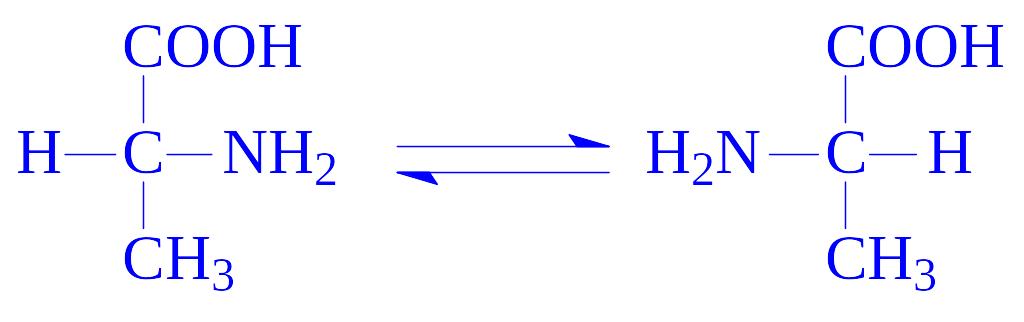
5.1. Рацемази і епімерази. Каталізують реакції інверсії асиметричних груп в молекулах різних речовин. Розрізняють чотири підпідкласи: рацемази і епімерази амінокислот і їх похідних, оксикислот і їх похідних, вуглеводів і їх похідних і інших сполук. Ферменти, що здійснюють реакції ізомеризації в субстратах з одним асиметричним атомом, називають рацемазами. До них слід віднести бактерійні ферменти, які перетворюють L-амінокислоти в D-амінокислоти, зокрема аланінрацемазу (аланінрацемаза, КФ 5.1.1.1):
Ферменти, що здійснюють перетворення субстратів з декількома асиметричними атомами вуглецю, називаються епімеразами. Так, УДФ-глюкозоепімераза (УДФ-глюкозо – 4-епімераза, КФ 5.1.3.2) в тканинах молочної залози ізомеризує УДФ-глюкозу в УДФ-галактозу, яка необхідна для біосинтезу лактози (за участі НАД і іонів Mg2+):
УДФ-глюкоза « УДФ-Галактоза
5.2. Цис-транс-ізомерази. Ці ферменти змінюють геометричну конфігурацію органічних сполук, що містять подвійні зв’язки. Зокрема, малеїнатізомераза (малеїнат – цис-транс-ізомераза, КФ 5.2.1.1) здійснює перетворення:

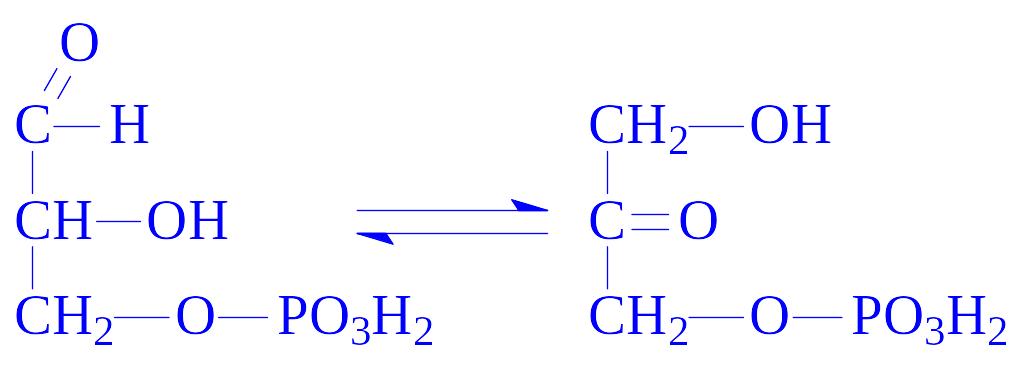
5.3. Внутрішньомолекулярні оксидоредуктази. Ці ферменти каталізують взаємні перетворення альдоз і кетоз. З їх участю окислюються –CH–ОН-групи, одночасно відновлюється сусідня СО-група. Так, тріозофосфатізомераза (D-гліцеральдегід-3-фосфат – кетол-ізомераза, КФ 5.3.1.1) каталізує реакцію:
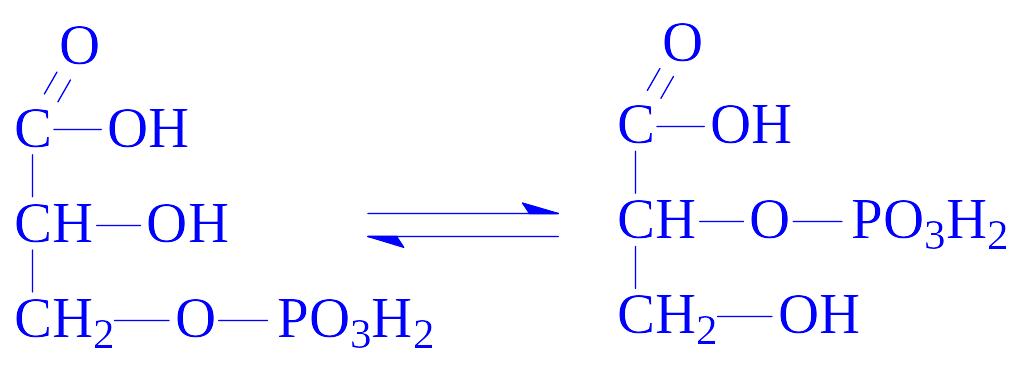
5.4. Внутрішньомолекулярні трансферази. Ці ферменти часто називають мутазами. Вони переносять певні групи з однієї частини молекули на іншу. Так, під впливом фосфогліцерат-фосфомутази (D-фосфогліцерат – 2,3-фосфомутази, КФ 5.4.2.1) відбувається реакція:
5.5. Внутрішньомолекулярні ліази. До ферментів, що каталізують внутрішньомолекулярні перетворення ліазного типу, відноситься муконат-циклоізомераза (4-карбоксиметил-4-оксиізокротонолактон – ліаза (дециклізуюча), КФ 5.5.1.1), що каталізує реакцію:
(+)-4-карбоксиметил-4-окси-ізокротонолактон = Цис-цис-муконат
6. лігази (синтетази)
Ці ферменти каталізують реакції з’єднання двох молекул та реакції спряжені з відщепленням залишків фосфорної кислоти від АТФ або її аналогів. Термін „лігази” застосовують також до ферментів, що каталізують реакції синтезу без нуклеозидтрифосфатів. Вони сприяють утворенню хімічних зв’язків, що власне і є причиною їх назви (від лат. ligare – зв’язувати). Механізм реакцій складний. Він є або трьохстадійним перенесенням, або утворенням потрійних комплексів. Кофакторами багатьох лігаз є біотин і його похідні. Число лігаз, відомих зараз, досягає 100.
6.1. Лігази, які утворюють С–О-зв’язки. До підкласу належать ферменти, що каталізують приєднання амінокислот до відповідних тРНК. Число лігаз відповідає кількості амінокислот, які використовуються для біосинтезу молекул білків. Утворюються аміноацил-тРНК. Так, тирозил-тРНК – синтетаза (L-тирозин: тРНК – лігаза (АМФ), КФ 6.1.1.1) за наявності іонів Mg2+ і K+ каталізує реакцію
АТФ + L-Тирозин + тРНК = АМФ + Пірофосфат + L-Тирозил-тРНК
6.2. Лігази, які утворюють С–S-зв’язки. Ці ферменти здійснюють утворення С–S-зв’язків між залишками жирних кислот і KoA. Зв’язок макроергічний. Активований залишок жирної кислоти залучається до всіляких реакцій синтезу або розщеплення. Так, під впливом ацетил-KoA – синтетази (ацетат: KoA – лігази (АМФ), КФ 6.2.1.1) і за наявності іонів Mg2+ в різних тканинах протікає реакція
АТФ + Ацетат + KoA = АМФ + Пірофосфат + Ацетил-КоА
6.3. Лігази, які утворюють С–N-зв’язки. Підклас складається з п’яти підпідкласів: амідсинтетази, пептидсинтетази, циклолігази, інші С–N-лігази і С–N-лігази з глутаміном в ролі N-донора. Особливе значення мають пептидсинтетази, під впливом яких з амінокислот синтезуються пептиди. Наприклад, g-глутамілцистеїнсинтетаза (L-глутамат:L-цистеїн – лігаза (АДФ), КФ 6.3.2.2) в тканинах печінки за наявності іонів Mg2+ каталізує реакцію утворення дипептида:
АТФ + L-Глутамат + L-Цистеїн = АДФ + Ортофосфат + g-L-глутаміл-L-цистеїн
6.4. Лігази, які утворюють С–С-зв’язки. З цього підкласу найбільш детально вивчена карбоксилаза, що каталізує реакцію карбоксилування. Так, під впливом піруваткарбоксилази (піруват: CO2 – лігази (АДФ), КФ 6.4.1.1) в тканинах за наявності іонів Mg2+ з піровиноградної кислоти і вуглекислого газу утворюється щавелевооцтова кислота:
АТФ + СН3–СО–СООН + СО2 + Н2О = НООС–СН2–СО–СООН + АДФ + Н3РО4
Другий фермент цього підпідкласу ацетил-КоА – карбоксилаза (ацетил-КоА:CO2 – лігаза (АДФ), КФ 6.4.1.2) каталізує утворення з ацетил-КоА і СО2 малоніл-КоА – проміжного продукту біосинтезу вищих жирних кислот:
АТФ + Ацетил-КоА +СО2 + Н2О = АДФ + Ортофосфат + Малоніл-КоА
Класифікація і номенклатура ферментів у ході розвитку біохімії і в результаті відкриття нових ферментів постійно удосконалюються, а їх число з кожним роком збільшується.
Взаємозв’язок між ферментами
Обмін речовин в організмі каталізується поліферментними системами, в які входять ферменти, що належать до всіх шести класів. Між ферментами існує взаємозв’язок, спадкоємність і послідовність. Для нормального протікання обмінних процесів необхідні оптимальні умови ферментативного каталізу. Відсутність одного з ферментів системи спричиняє за собою порушення обміну речовин організму в цілому.
Зв’язок між ферментами може носити різний характер. Наприклад, в порожнині шлунку під впливом пепсину починається розщеплення білків продуктів харчування, надалі ці процеси продовжуються, завершуючись в тонкій кишці внаслідок дії ферментів трипсина, хімотрипсина, амінополіпептидаз, карбоксиполіпептидаз, три- і дипептидаз. Часто система зв’язку між ферментами створюється за допомогою проміжних продуктів реакції, причому продукт, що виник в результаті діяльності одного ферменту, є субстратом для наступного ферменту. Прикладами може бути анаеробна фаза розщеплення вуглеводів, цикл трикарбонових кислот, b-окислення жирних кислот, орнітиновий цикл утворення сечовини та ін. Продукти реакції одного ферменту в надлишку можуть гальмувати його активність або активність іншого ферменту. Так, надлишок молочної кислоти в середовищі гальмує активність ЛДГ. Такий вид гальмування діяльності ферментів називається субстратним, оскільки фермент, який сприяє утворенню субстрата, сам виявляється заблокованим. Якщо субстрат гальмує активність ключового ферменту, яким починається метаболічний цикл, таке гальмування називається ретроградним. Так, надлишок молочної кислоти – одного з головних кінцевих продуктів анаеробного глікогенолізу або гліколізу, гальмує діяльність гексокінази, з якої починається розпад глікогену або глюкози. Виникає гальмування діяльності ферменту за принципом зворотного зв’язку.
Існує спадкоємність в діяльності ферментів різних класів. Так, поживні речовини під впливом гідролаз травних соків розщеплюються на прості речовини (монози, гліцерин, жирні кислоти, амінокислоти і т.д.). Вони поступають у кровоносну систему, потім – до органів, тканини і клітини. В клітинах під впливом різних лігаз з них утворюються речовини, необхідні для пластичних, захисних, регуляторних, енергетичних і інших потреб. Такі ферменти прийнято називати регуляторними. Вони зазвичай розміщені на початку мультиферментної системи. Продукт ферментативної реакції в даному випадку діє як алостеричний інгібітор.
У ряді випадків взаємозв’язок ферментів між собою здійснюється генетично, тобто кодується генетичною інформацією, закладеною в молекулі ДНК, і передається через синтез ферментативних білків. Окремі ферменти можуть синтезуватися в клітинах під впливом певного субстрату. На відміну від конституційних ферментів, які завжди присутні в клітині, ці ферменти називають адаптивними, або індуцибельними. Вони синтезуються в клітині у результаті депресії генів, що не допускає утворення цих ферментів, як відповідь на появу в середовищі індуктора-субстрату. Іноді наступає дерепресія синтезу групи ферментів, оскільки дерепресується група генів, розміщених в частині молекули ДНК, відповідальної за синтез цих білків, – опероні.
Ферменти в народному господарстві, медицині, ветеринарії і зоотехнії
Ферменти широко використовуються в народному господарстві. Так, в хлібопеченні застосовують ферментативні препарати, які покращують якість і аромат хліба. Дозрівання тіста прискорюється на 30%, а витрата цукру на виготовлення булочних виробів зменшується в 2 рази. В шкіряному і хутряному виробництві застосовуються препарати пептидогідролаз, які прискорюють видалення шерсті із шкіри і розм’якшення її у декілька разів, а також підвищують сортність і якість шкіри і хутра. Лізоцим застосовується як консервант коров’ячого молока та ікри осетрових риб. Глюкозооксидаза використовується як антиокислювач при зберіганні м’яса, фруктових соків, непастеризованих пива і вина. Використання препарату бактерійної амілази дає можливість зменшити витрату ячменю на виробництво одного декалітра пива на 165 г.
У медицині і ветеринарії широко застосовується ензимодіагностика. Так, багато захворювань печінки (жовтяниця, гепатити, цирози) діагностуються по збільшенню в крові вмісту лужної фосфатази. При різних захворюваннях печінки в крові збільшується вміст альдолази і трансамінази і різко зменшується вміст амілази. Поява в сечі і крові ізоферментів ЛДГ4 і ЛДГ3 може бути ознакою деяких захворювань нирок, ізофермента ЛДГ3 – легень. При інфаркті міокарду в крові зростає вміст амінотрансфераз і альдолази.
Багато ферментів застосовуються з терапевтичною метою. Так, препарат трипсину в поєднанні з антибіотиками використовується при лікуванні хронічних виразок кінцівок, карбункулів, фурункулів, панариціїв (запалення нігтьового ложа) і піодермії (гнійне запалення шкіри). Панкреатична ДНК-аза застосовується при лікуванні деяких респіраторних захворювань. Гіалуронідаза застосовується в невеликих дозах для прискорення всмоктування різних ліків, що вводяться підшкірно. Препарати гіалуронідази застосовуються в хірургії, в офтальмології, тваринництві, гінекології. Вони використовуюся для розсмоктування гематом, ексудатів і транссудатів. Для руйнування тромбів часто використовують фібринолізин. Аспарагіназа, яка розщеплює аспарагін, необхідний для синтезу білків раковими клітинами, застосовується при лікуванні злоякісних утворень.
