
- •1 Питання
- •2 Питання
- •3 Питання
- •1 Питання
- •Класифікація елементарних частинок
- •Типи взаємодії
- •2 Питання
- •3 Питання
- •1 Питання
- •2 Питання
- •3 Питання
- •1 Питання Закон збереження імпульсу
- •Закон збереження енергії в механіці.
- •Закон збереження моменту імпульсу
- •2 Питання
- •Класи з поглибленим вивченням фізики
- •Профільне вивчення
- •3 Питання
- •1 Питання Основні поняття
- •Ентропія
- •Властивості ентропії
- •Способи зміни внутрішньої енергії
- •2 Питання
- •3 Питання
1 Питання Основні поняття
Об'єкт дослідження в термодинаміці в узагальненому вигляді називають термодинамічною системою. Під термодинамічною системою розуміють деяку речовину, здебільшого задану параметрами її стану.
До основних понять і величин у термодинаміці належать внутрішня енергія, робота і кількість теплоти.
Внутрішня енергія. Під внутрішньою енергією системи розуміють сумарну енергію всіх видів частинок, з яких складається система. Сюди входить кінетична і потенціальна енергія молекул, енергія коливальних рухів атомів у молекулах, енергія електронних оболонок в атомах та іонах і внутрішньоядерна енергія. До внутрішньої не відноситься енергія системи як цілого, яку вона може мати в результаті механічного руху або взаємодії з іншими системами. Інакше кажучи, внутрішньою енергією називають сумарну енергію мікрочастинок, з яких складається система. Внутрішня енергія є функцією стану системи, тобто змінюється із зміною стану системи і однозначно визначається тими самими параметрами, що й система. У термодинаміці практичне значення має не сама внутрішня енергія, а її зміна з переходом системи з одного стану в інший.
Робота. У термодинаміці поняття про роботу набуває ширшого змісту, бо стан системи і відповідно її внутрішню енергію, як функцію стану, можна змінювати завдяки виконанню і макроскопічної, і мікроскопічної роботи. Остання здійснюється без будь-якого видимого переміщення тіл, що взаємодіють, її інакше називають теплообміном.
Кількість теплоти. макроскопічна робота і теплообмін — способи зміни внутрішньої енергії системи. Кількісною мірою процесу макроскопічної роботи є фізична величина, яка також називається роботою. Кількісною мірою процесу теплообміну є фізична величина, що називається кількістю теплоти. Кількість теплоти і робота, як величини, що визначають зміну внутрішньої енергії системи, у реальних процесах можуть бути взаємно зв’язаними і визначати одна одну.
Перше начало термодинаміки
Теплота,
що надходить в систему витрачається на
збільшення внутрішньої енергії і на
виконання роботи. 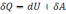
Оборотні і необоротні процеси
За початками Р. Клаузіуса термодинамічні процеси поділяють на два види.
Оборотним називають такий процес, який може відбуватися в обох напрямках. Після завершення такого процесу в прямому і зворотному напрямах система повертається в початковий стан і в навколишньому середовищі не залишається ніяких слідів.
Якщо процес не має перелічених вище ознак, то його називають необоротним.
Другий початок термодинаміки
1. Клаузіус (1850): неможливий мимовільний перехід тепла від менш до більш нагрітого тіла, або неможливі процеси, єдиним кінцевим результатом яких був би перехід тепла від менш до більш нагрітого тіла.
2. Томпсон: вічний двигун 2-го роду неможливий, бо неможливо створити тепловий двигун з ККД η = 1.
Третій закон термодинаміки
Теорема Нернста (1906). Ця теорема стверджує, що при наближенні температури до абсолютного нуля ентропія макросистеми не змінюється: ΔS → 0 при T → 0 (3.4)
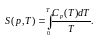 (3.5)
(3.5)
Звідси слідує, що при Т → 0 теплоємність Ср всіх макросистем повинна теж прямувати до нуля (інакше інтеграл не буде сходитися).
Теорема Нернста не може бути логічно виведена з перших двох початків, тому її часто називають третім початком термодинаміки
