
Світлотехнічні величини :
Дисперсія світла — залежність показника заломлення (або діелектричної проникності) середовища від частоти хвилі світла.
Здебільшого показник заломлення зростає при збільшенні частоти. Це зростання називають нормальною дисперсією. Аномальна дисперсія — зменшення показника заломлення при збільшенні частоти — виникає в спектральних областях, близьких до частот інтенсивного поглинання.
Суцільний спектр – спектр, у якого монохроматичні складові заповнюють без розривів інтервал довжин хвиль, в межах якого відбувається випромінювання.
Види спектрів :
Розрізняють спектр випромінювання й спектр поглинання тіла. Спектр випромінювання - це набір монохроматичних хвиль, які випромінює дане тіло. При вимірюванні спектру поглинання тіло опромінюють білим світлом і фіксують частоти променів, які пройшли через нього. Аналогічним чином вимірюється спектр відбиття - фіксуються частоти променів, відбитих тілом.
Спектральний аналіз — сукупність методів визначення складу (наприклад, хімічного) об'єкта, заснований на вивченні спектрів взаємодії матерії з випромінюванням: спектри електромагнітного випромінювання, радіації, акустичних хвиль, розподілу за масою та енергією елементарних частинок та інше. Спектральний аналіз грунтується на явищі дисперсії світла. Традиційно розмежовують:
атомарний та молекулярний спектральний аналіз,
«емісійний» — за спектром випромінення та «абсорбційний» — за спектром поглинання,
«мас-спектрометричний» — за спектром мас атомарних чи молекулярних іонів.
Принцип дії :
Атоми кожного хімічного елемента мають певні резонансні частоти, внаслідок чого саме на цих частотах вони випромінюють або поглинають світло. Це призводить до того, що в спектроскопі на спектрах видимі лінії (темні або світлі) в певних місцях, характерних для кожної речовини. Інтенсивність ліній залежить від кількості речовини і її стану. У кількісному спектральному аналізі визначають зміст досліджуваної речовини за відносною або абсолютною інтенсивністю ліній або смуг у спектрах.
Закон Кірхгофа :
Випромінювальна здатність ε будь-якого тіла дорівнює його коефіцієнту поглинання при заданих температурі Т і довжині хвилі λ: ε (λ, Т) = α (λ, Т).
Інфрачервоне випромінювання – це частина спектру випромінювання Сонця, яка безпосередньо примикає до червоної частини бачимої ділянки спектру та котра спроможна нагрівати більшість предметів. Око людини неспроможне бачити в цій частині спектру, але ми можемо відчувати тепло. Відомо, що будь-який об’єкт, чия температура перевищує (– 273) градусів Цельсія випромінює, а спектр його випромінювання визначається тільки його температурою та інтенсивністю випромінювання. Інфрачервоне випромінювання має дві важливі характеристики : довжину хвилі (частоту) випромінювання та інтенсивність.
Ультрафіолетова частина спектру — невидиме оком людини електромагнітне випромінювання, що займає спектральну область між видимим і рентгенівським випромінюваннями в межах довжин хвиль 400-10 нм.
Уся область ультрафіолетового випромінювання умовно ділиться на:
довгі ультрафіолетові хвилі від 315 до 400 нм;
середні ультрафіолетові хвилі від 280 до 315 нм;
короткі ультрафіолетові хвилі від 10 до 280 нм.
УФ - випромінювання може порушувати хімічні зв'язки в молекулах, внаслідок чого можуть відбуватися різні хімічні реакції (окислення,відновлення, розклад, полімеризація). Люмінесценція під дією УФ - випромінювання використовується при створенні люмінесцентних ламп, фарб, що світяться, в люмінесцентному аналізі і люмінесцентній дефектоскопії. Ультрафіолетове випромінювання застосовується в криміналістиці для встановлення ідентичності фарбників, автентичності документів тощо. В мистецтвознавстві дозволяє знайти на картинах не видимі оком сліди реставрацій.
Рентгенівське випромінювання - короткохвильове електромагнітне випромінювання з довжиною хвилі від 10 нм до 0.01 нм. В електромагнітному спектрі діапазон частот рентгенівського випромінювання лежить між ультрафіолетом та гамма-променями.
Рентгенівське випромінювання виникає від різкого гальмування руху швидких електронів у речовині, при енергетичних переходах внутрішніх електронів атома. Воно використовується у науці, техніці, медицині.
Тиск світла - тиск, який світло чинить на тіло, в якому поглинається, або від якого відбивається.
Теоретично існування світлового тиску передбачив Максвелл в 1871 році, а експериментально дослідив П. М. Лебедєв у 1900.
Уперше
тиск світла виміряв у 1899 р. російський
фізик П. М. Лебедєв за допомогою підвішеної
у вакуумі на тонкій кварцовій нитці
легкої «крильчатки», одне крильце якої
було відбиваючим (дзеркало), інше —
поглинаючим (зачорненим).
Тиск
світла на відбиваюче крильце був удвічі
більшим, ніж на поглинаюче (у першому
випадку під час падіння-відбивання
перешкода одержує імпульс ![]() ,
у другому — тільки
,
у другому — тільки ![]() ).
).
Хімічна дія світла проявляється в тому, що існує цілий ряд хімічних перетворень, що відбуваються тільки під дією світла. Хімічні реакції, що протікають під дією світла, називають фотохімічними. Фотохімічна реакція – розривання електронних зв’язків у молекулі речовини під час поглинаня нею фотона, тобто поділ її на атоми під дією світла. Хімічна дія світла лежить і в основі фотографії. Чутливий шар фотопластини складається з маленьких кристалів броміду срібла (AgBr), вкраплених в желатин. Попадання фотонів в кристал приводить до відриву електронів від окремих іонів брому. Ці електрони захоплюються іонами срібла, і в кристалі утворюється невелика кількість нейтральних атомів срібла.
Люмінесценція – нетеплове світіння речовини, що відбувається після поглинання ним енергії збудження. Речовина, у якій спостерігається люмінесценція, називається люмінофором.
Люмінесцентне випромінювання виникає за рахунок квантових переходів атомів, іонів,молекул зі збудженого стану в основний чи менш збуджений, тому кожен атом, іон чи молекула люмінофора є центром люмінесценції.
Види люмінесценції:
Довготривалу люмінесценцію називають фосфоресценцією, а короткотривалу флуоресценцією.
За механізмом розрізняють такі різновиди люмінесценції: резонансну, спонтанну, вимушену та рекомбінаційну.
За типом збудження розрізняють фотолюмінесценцію, рентгенолюмінесценцію, катодолюмінесценцію, хемолюмінесценцію, кріолюмінесценцію, електролюмінесценцію, триболюмінесценцію, радіолюмінесценцію, термолюмінесценцію тощо.
46. Телебачення є одним з найбільш масових засобів інформації, освіти, політичного і культурного виховання людства; також одним з основних засобів зв'язку, широко використовуваним у наукових дослідженнях при обсервації об'єктів з віддалі, в техніці, промисловості, транспорті, будівництві, сільському господарстві, метеорології, космічних і нуклеарних дослідженнях, у військовій справі тощо.
Електронно-променева трубка (ЕПТ) — електронний прилад, який має форму трубки, видовженої (часто з конічним розширенням) в напрямку осі електронного променя, що формується в ЕПТ. ЕПТ складається з електронно-оптичної системи, відхиляючої системи і флуоресцентного екрана або мішені.
Класифікація ЕПТ надзвичайно ускладнена, що пояснюється їх надзвичайно широким застосуванням у науці та техніці і можливістю модифікації конструкції з метою одержання технічних параметрів, які необхідні для реалізації конкретної технічної ідеї.
Залежно від методу управління електронним променем ЕПТ поділяються на:
електростатичні (з електростатичною системою відхилення променів);
електромагнітні (з електромагнітною системою відхилення променів).
Залежно від призначення ЕПТ поділяються на:
електронно-графічні трубки (приймальні, телевізійні, осцилографічні, індикаторні,
запам'ятовуючі, знакодрукувальні, кодувальні та ін.);
оптико-електронні претворюючі трубки (передавальні телевізійні трубки, електронно-оптичні перетворювачі та ін.);
електронно-променеві перемикачі (комутатори);
інші ЕПТ.
Електронно-графічні ЕПТ — група електронно-променевих трубок, які застосовуються в різноманітних галузях техніки, для перетворення електричних сигналів в оптичні (перетворення типу «сигнал — світло»).
Електронно-графічні ЕПТ поділяються:
Залежно від області застосування:
приймальні телевізійні (кінескопи, ЕПТ з надвисокою роздільною здатністю для спеціальних телевізійних систем, та ін.);
приймальні осцилографічні (низькочастотні, високочастотні, надвисокочастотні, імпульсні високовольтні та ін.);
приймальні індикаторні;
запам'ятовуючі;
знакодрукувальні;
кодувальні;
інші ЕПТ.
47. Фотон - квант електромагнітного поля, елементарна частинка, що є носієм електромагнітної взаємодії.
Фотон має лише релятивіську масу і не має маси спокою. Фотон має масу доти, доки він рухається зі швидкістю світла. Якщо фотон зіштовхується з перешкодою, енергія фотона переходить до перешкоди і його маса зникає.
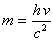 ,
,
![]() - імпульс.
- імпульс.
Енергію фотона можна також виразити через циклічну частоту коливань w:
E = hn = w![]() ,
де
,
де 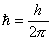 -
зведена стала Планка.
-
зведена стала Планка.
48. Коли електрон переходить із однієї орбіти на іншу, різниця в енергії випромінюється (або поглинається) єдиним квантом світла (фотоном), частота якого напряму залежить від енергетичної різниці між двома орбітами.
![]() ,
де ν —
це частота фотона, E —
різниця енергій, а h —
константа пропорційності, також відома
як стала
Планка.
,
де ν —
це частота фотона, E —
різниця енергій, а h —
константа пропорційності, також відома
як стала
Планка.
Постулати Бора:
1. Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія En. У стаціонарному стані атом енергію не випромінює.
2. Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких hν визначають за формулою:
hνkn = Ek − En,
де k і n - цілі числа (номери стаціонарних станів), якщо Ek > En фотон з частотою νkn випромінюється, якщо Ek < En - поглинається.
3. Радіуси rn стаціонарних станів задовольняють умову:
![]() ,
,
де n =
1,2,3,..., m
-
маса
електрона, ![]() -
зведена стала Планка.
-
зведена стала Планка.
Поглинаючи світло, атом переходить із стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією. Усі стаціонарні стани, крім одного, є умовно стаціонарними. Нескінченно довго кожен атом може знаходитись лише в стаціонарному стані з мінімальним запасом енергії. Цей стан атома називається основним, всі інші - збудженими.
49. Досліди Розерфорда:
Одночасно з моделлю Томсона японський фізик Хантаро Нагаока розробив іншу модель, з умовною назвою «сатурніанський атом». У ній припускалось, що електрони по спільній орбіті (як по «кільцю Сатурна») рухаються навколо позитивно зарядженого ядра. Здійснити вибір між цими двома моделями атома дозволили результати дослідів, проведених в Англії, в лабораторії Ернеста Резерфорда його учнями Ернестом Марсденом і Гансом Гейгером. На металеву фольгу F, розташовану в центрі вакуумної камери К, спрямовували потік α-частинок (ядер гелію), які вилітали з радіоактивного препарату R; через мікроскоп М спостерігали (за спалахами світла на екраніS з сірчистого цинку) їх розсіювання фольгою. Мікроскоп разом з екраном обертали навколо осі, що проходила через центр камери; це дозволяло реєструвати α-частинки, розсіювані під різними кутами. Було виявлено, що більшість частинок проходять крізь фольгу майже безперешкодно, але невелика кількість частинок відкидається майже назад, відхиляючись ядром.
Експерименти переконливо довели недостовірність моделі Томсона та існування ядер в атомах. Таким чином, було обґрунтовано ядерну модель атома (атом Резерфорда).
50. Склад атомного ядра:
Український фізик Іваненко і німецький фізик Гейзенберг 1932 року незалежно один від одного запропонували протонно-нейтронну модель ядра, згідно з якою ядро складається із протонів і нейтронів. Оскільки атом в цілому електронейтральний, а заряд протона дорівнює модулю заряду електрона, то число протонів у ядрі дорівнює числу електронів в атомній оболонці. Відповідно число протонів в ядрі дорівнює атомному номеру елемента в періодичній системі елементів Менделєєва. А кількість нейтронів дорівнює різниці між атомною масою ізотопу і значенням порядкового номера.
Ізотопи - нукліди одного і того самого хімічного елементу, які мають різну атомну масу.
Ізотопи позначають тими самими символами, що і хімічний елемент, додаючи зверху з лівого боку символу число, що показує масу даного ізотопу, виражену у вуглецевих одиницях. Переважна більшість ізотопів не має спеціальних назв, але для ізотопів деяких елементів існують спеціальні назви і навіть спеціальні символи.
