
- •Ответы на вопросы части Кисиль Оглавление
- •Функциональные особенности.
- •Дополнительно.
- •Мал.1. Рослинна (1) і тваринна (2) клітини
- •Механізм трансляції Загальні відомості
- •А. Модель Михаэлиса-Ментен
- •Б. Определение V и Кm
- •Хлоропласт
- •Мітохондрія
- •If1 (inhibitory factor 1 — «інгібуючий фактор 1»)
- •Б удова і принцип роботи
- •Фізіологічна роль
- •Особенности протонного мотора бактерий:
Функциональные особенности.
В функциональном отношении две цепи ДНК не эквивалентны. Кодирующей цепью (матричной, смысловой) является та из них, которая считывается в процессе транскрипции. Именно эта цепь служит матрицей для PHK. Некодирующая цепь (антисмысловая) по последовательности подобна РНК (при условии замены T на U). Общепринято давать структуру гена в виде последовательности некодирующей цепи ДНК в направлении 5'→3'. Если прочитать кодоны в этом направлении, то с помощью генетического кода можно воспроизвести аминокислотную последовательность белка в принятом порядке, от N- к С-концу.
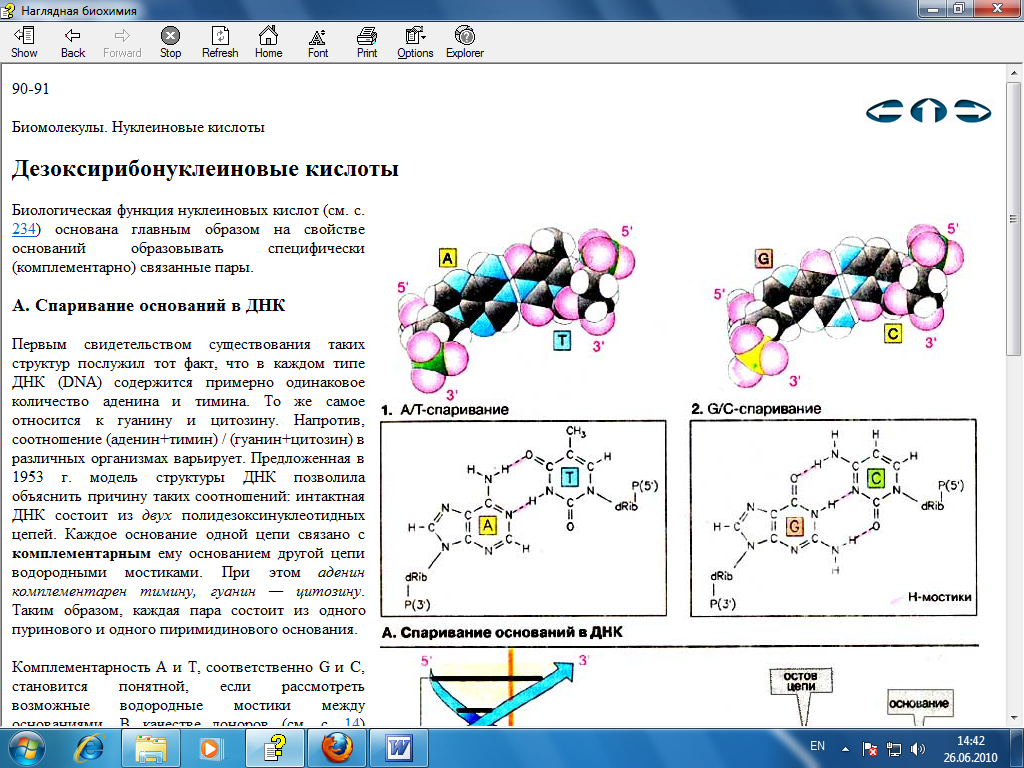

K-2. Вторичная структура ДНК.
В соответствии с моделью Дж. Уотсона и Ф. Крика, предложенной в 1953 г. на основании ряда аналитических данных, а также рентгеноструктурного анализа молекула ДНК состоит из двух цепей, образуя правовращающую спираль, в которую обе полинуклеотидные цепи закручены вокруг одной и той же оси. Удерживаются цепи благодаря водородным связям, образующимся между их азотистыми основаниями (рис. 3.1). Обе цепи поли-нуклеотидов в биспиральной молекуле ДНК имеют строго определенное пространственное расположение, при котором азотистые основания находятся внутри, а фосфорильные и углеводные компоненты – снаружи.
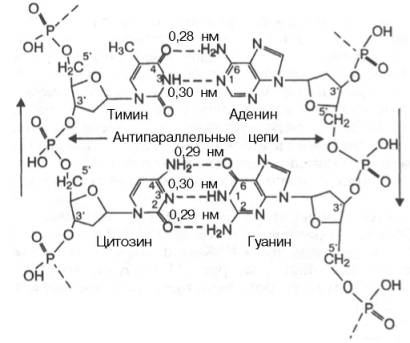
Детальный анализ всевозможных вариантов образования водородных связей между основаниями показал, что в биспиральной молекуле ДНК основания уложены парами: пурин из одной цепи и пиримидин из другой в соответствии с правилами Чаргаффа. Поскольку ориентация оснований на плоскости не является, очевидно, произвольной, и основания в поли-нуклеотидах представлены в лактамной форме, наиболее вероятными были признаны пары аденин–тимин и гуанин–цитозин. Этот способ спаривания получил в дальнейшем экспериментальное подтверждение. Избирательность взаимодействия пар А–Т и Г–Ц принято выражать термином «комплементарность», а соответствующие азотистые основания называют комплементарными. Стабильность А–Т оснований обеспечивается двумя водородными связями, а пар Г–Ц – тремя, что в свою очередь определяется особенностями расположения функциональных групп азотистых оснований. Длина водородных связей между основаниями составляет около 0,3 нм. Таким образом, комплементарными оказываются не только отдельные основания, но и дезоксирибонуклеотидные цепи ДНК в целом, способствующие образованию весьма компактной структуры и стабилизации всей молекулы.

Рис. 3.1. Схематическое изображение двойной спирали ДНК. а - по Уотсону и Крику : с - остаток дезоксирибозы, р - остаток фосфорной кислоты; б - А-фор-ма ДНК; в - В-форма ДНК.
Обе цепи в молекуле ДНК имеют противоположную полярность. Это означает, что межнуклеотидная связь в одной цепи имеет направление 5'–>3', а в другой – 3'–>5'. Подобная направленность цепей имеет важное биологическое значение при репликации и транскрипции молекулы ДНК.
На модели ДНК (см. рис. 3.1) видно, что расстояние между витками (шаг спирали) равно 3,4 нм. На этом участке укладываются 10 нуклеотид-ных остатков, размер одного нуклеотида составляет 0,34 нм; диаметр биспиральной молекулы равен 1,8 нм.
Необходимо указать, что конфигурация двойной спирали ДНК сильно меняется в зависимости от количественного содержания воды и ионной силы окружающей среды. Методами рентгеноструктурного анализа доказано существование по крайней мере 6 форм ДНК, названных А-, В-, С-, D-, Е- и Z-формами. Конфигурация двух из них в простейшей форме представлена на рис. 3.1, б и в. Можно увидеть, что у А-формы наблюдается некоторое смещение пар оснований от оси молекулы к периферии, что отражается на размерах (2,8 нм – длина одного витка, в котором вместо 10 содержится 11 мононуклеотидов; меняется расстояние между нуклеотидами и др.). Если А- и В-формы представляют собой правозакрученную двойную спираль, то Z-форма (зигзагообразная) ДНК имеет левозакрученную конфигурацию, в которой фосфодиэфирный остов располагается зигзагообразно вдоль оси молекулы. Параллельно фосфодиэфирному остову в структуре А- и В-форм ДНК имеются большая и малая бороздки (желобки) – сайты, где присоединяются белки, выполняющие, очевидно, регуляторные функции при экспрессии генов. В настоящее время есть основание считать, что между А- и В-формами ДНК осуществляются взаимные переходы при изменении концентрации соли и степени гидратации. В-форма ДНК больше всего подходит к модели Уотсона и Крика. В этих переходах, которые могут быть вызваны растворителями или белками, очевидно, заключен определенный биологический смысл. Предполагают, что в А-форме ДНК выполняет роль матрицы в процессе транскрипции (синтез РНК на молекуле ДНК), а в В-форме – роль матрицы в процессе репликации (синтез ДНК на молекуле ДНК).
K-3. Типы химических связей
Варианты классификации химических связей определяются различными характеристиками или способами описания. В теории валентности каждой связи между атомами соответствует одна электронная пара. В зависимости от способа её образования из электронов связываемых атомов можно выделить ковалентную и координационную связь. Если электронная пара полностью принадлежит одному из атомов, то образуется ионная связь. По степени смещения центра тяжести электронного облака связывающих электронов химическую связь делят на неполярную и полярную. Ковалентные и координационные связи принято подразделять по числу образующих их электронных пар на простые и кратные (двойные, тройные, четверные). Существуют также классификации связей по результатам квантово-механических расчётов волновых функций веществ. Это: двухцентровые (С-С; С-Н) и многоцентровые связи (например: металлическая связь в кристаллической решётке). В биологически важных молекулах особо выделяют водородные, гидрофобные, гидрофильные и Ван-дер-ваальсовые связи.
Ковалентная химическая связь образуется электронами общими для двух атомов. Связь, объединяющая в кристаллах и молекулах нейтральные атомы на валентных орбиталях которых имеются неспаренные электроны. Связь возникает за счет обобществления электронной пары посредством обменного механизма. Два общих электрона образуют одинарную связь, четыре - двойную, а шесть - тройную связь, энергия которой 100-1000 кДж/моль и распределяется приблизительно следующим образом среди наиболее часто встречающихся в биологической химии комбинаций
Ковалентная связь |
Энергия ковалентной связи, кДж/моль |
-S-S-связи |
210 |
С-N |
305 |
С-С |
350 |
С-Н |
414 |
С=С |
610 |
С=О |
720 |
Первичная структура макромолекул |
146-880 |
Водородные связи возникают в результате дипольных взаимодействий. Чаще всего они имеют место в тех молекулах, где атомы Н связаны с О, N или галогенами, особенно F. Высокая электроотрицательность этих элементов и малый объём атома Н, образующего положительный конец диполя, приводят к исключительно высокой полярности этой связи. Тогда водород в форме Н+ сильно притягивается заряженной группой другой полярной молекулы. Таким образом, одна связь является сильно полярной ковалентной связью, а другая осуществляется в результате электростатического взаимодействия. Энергия водородной связи находится в пределах 10-50 кДж/моль. Межмолекулярные водородные связи оказывают сильное воздействие на физические свойства многих веществ и, в первую очередь, воды. Внутримолекулярные водородные связи являются важным фактором, стабилизирующим форму молекул (например, белков) и лежат в основе некоторых из их свойств (например, сократимости). Разрыв водородных связей приводит к существенному изменению всей молекулы, а в случае белков - к их денатурации. Водородные связи во многом обуславливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты,амиды карбоновых кислот, сложные эфиры). Аномально высокая теплоемкость воды и многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учетом бифуркатных связей Н-связей до 5-6). Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Гидрофобные взаимодействия (гидрофобность или лиофобность) связывают неполярные (гидрофобные) части одной или разных молекул в водных растворах, характеризуя способность вещества взаимодействовать с жидкой средой. Энергия каждого такого взаимодействия не велика и может находиться в пределах 1-10 кДж/моль. Однако взаимодействие большого числа длинных молекулярных цепей приводит к возникновению весьма устойчивых систем, способных быть очень чувствительными к изменению статических, электростатических и иных сил и полей в своём окружении. Существование таких связей и их сила определяются изменением энтропии системы и играют важную роль в стабилизации конформаций биополимеров, образовании структур биологических мембран, регулируемых активностей мембранных образований. В особенности это касается трансмембранных белковых структур (например: ионоселективных каналов, аденилатциклазы, гексокиназы и др.).
Ван-дер-ваальсовые взаимодействия складываются из сил отталкивания атомов, обусловленных перекрыванием их электронных плотностей и дисперсионного взаимного притяжения. При сближении атомов электроны, имеющие противоположно направленные спины, отталкиваются. В результате такого отталкивания электронная плотность в пространстве между ядрами двух взаимодействующих атомов уменьшается. Это и приводит к увеличению энергии межъядерного отталкивания. Таким образом, Ван-дер-ваальсовое отталкивание атомов складывается из отталкивания электронов и электростатического отталкивания дезэкранированных ядер (вследствие взаимодействия атомарных электронов). Энергия Ван-дер-Ваальсового взаимодействия приблизительно составляет 0,1-1 кДж/моль.
