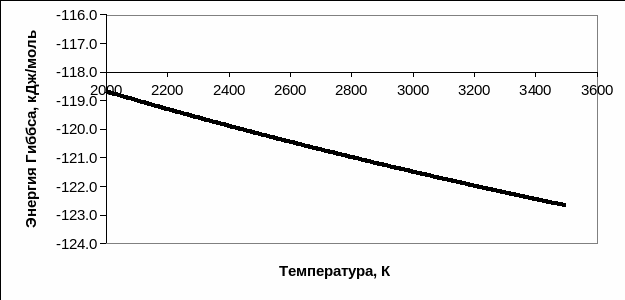
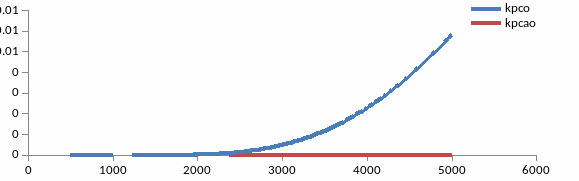
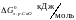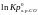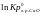Графическое представление результатов расчетов:

Вывод: меньший химический потенциал в данных условиях имеет реакция окисления железа. На основании расчета делаем выводы, что в сварочной ванне преимущественным процессом будет реакция окисления железа.
Задача№ 5. Расчет процессов диссоциации газов в зоне дуги.
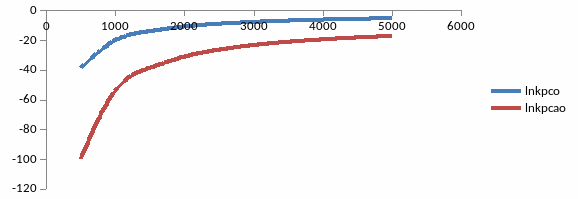
Сравнить константу равновесия реакции диссоциации газов и оксидов и степень диссоциации в зоне дуги (Т=500-5000К)
Найдем энергию Гиббса по формуле:
Реакция 1:
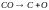
Найдем энергию Гиббса :
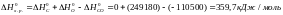
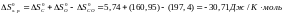
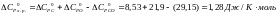
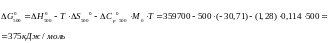
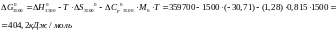
Реакция 2:
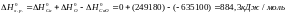
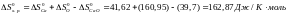

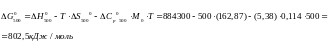
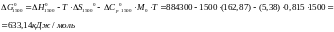
T |
M0 |
|
|
|
|
500 |
0,1135 |
374.962 |
802.56 |
-38.677 |
-99.642 |
1000 |
0,5087 |
389.739 |
718.693 |
-20.111 |
-53.949 |
1500 |
0,8148 |
404.181 |
633.42 |
-13.91 |
-38.669 |
2000 |
1,0528 |
418.405 |
547.232 |
-10.804 |
-31.005 |
2500 |
1,2462 |
432.467 |
460.364 |
-8.937 |
-26.392 |
3000 |
1,4086 |
446.401 |
372.955 |
-7.69 |
-23.308 |
3500 |
1,5486 |
460.227 |
285.095 |
-6.798 |
-21.098 |
4000 |
1,6715 |
473.962 |
196.85 |
-6.128 |
-19.435 |
4500 |
1,7810 |
487.617 |
108.268 |
-5.605 |
-18.138 |
5000 |
1,8797 |
501.2 |
19.386 |
-5.187 |
-17.098 |

Задача№6. Расчет процессов формирования газовой защиты при ручной дуговой сварке.
Определить парциальное давление защитного газа при дуговом нагреве MnCO3 в качестве компонента электродного покрытия, находящегося на поверхности (Тс=15000С) стержня и в капле жидкого металла (ТК=35000С).
Решение:
1) Реакция диссоциации MnCO3.
MnCO3 -> MnO + CO2
2) Определение энергии Гиббса
1) Определяем приращение энтальпии химической реакции:
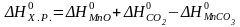
 .
.
2) Определяем приращение энтропии химической реакции:
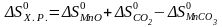 ,
,
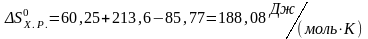 .
.
3) Определяем приращение теплоемкости химической реакции:
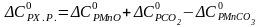 ,
,
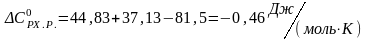 .
.
4) Выражение для определения энергии Гиббса:
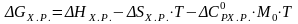 .
.
Тогда с учетом рассчитанных значений приращения энтальпии и энтропии химической реакции получаем выражение для определения энергии Гиббса:
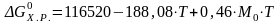
-
Температура
DG
LnKp
750
-24.429
2204.783
950
-61.949
7082.016
1150
-99.45
13762.64
1350
-136.934
22245.6
1550
-174.404
32530.23
1750
-211.863
44616.16
1950
-249.311
58502.58
2150
-286.75
74189.23
2350
-324.18
91675.45
2550
-361.602
110960.9
2750
-399.017
132045.3
2950
-436.425
154928.2
3150
-473.827
179609.5
3350
-511.223
206088.7
3550
-548.614
234365.8
Парциальное давление огромно. Программа не может посчитать столь огромные числа, как е20000
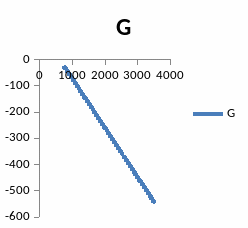
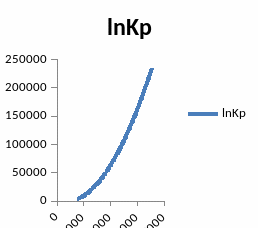
Задача№7. Рафинирование сварочной ванны.
Рассчитайте реакцию рафинирования, т.е. связывания S или P, растворенных в жидком металле (Т=1900К) в хим. соединения, не растворимые в ванне.
FeS+Ti ->TiS + Fe
Сделать вывод о возможности очистки ванны от этих продуктов реакции.
Сделать вывод о возможностях i-го рафинирования при сварке стали.
Решение.
Для вычисления энергии
Гиббса пользуемся упрощенной формулой:
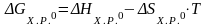
1) Определяем приращение энтальпии химической реакции:
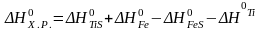
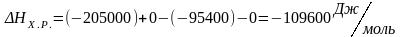 2)
Определяем приращение энтропии химической
реакции:
2)
Определяем приращение энтропии химической
реакции:
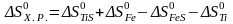 ,
,
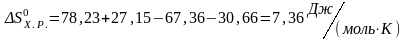
3) Определяем приращение теплоемкости химической реакции:
 ,
,
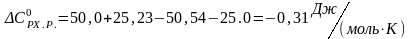 .
.
4) Выражение для определения энергии Гиббса:
.
Тогда с учетом рассчитанных значений приращения энтальпии и энтропии химической реакции получаем выражение для определения энергии Гиббса:
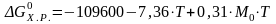
При Т=1900К
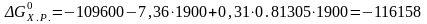
Вывод: поскольку энергия Гиббса при Т=1900К значительно ниже 0, реакция будет протекать в прямом направлении, т.е. титан способен очистить сталь от серы в процессе сварки. Процесс рафинирования возможен.
По результатам вычисления получаем таблицу значений энергии Гиббса:
-
T
M0
2000
1,0528
-118,6878
2100
1,0945
-118,9995
2200
1,1346
-119,3034
2300
1,1731
-119,5999
2400
1,2103
-119,8893
2500
1,2462
-120,1719
2600
1,2808
-120,4480
2700
1,3143
-120,7178
2800
1,3467
-120,9816
2900
1,3781
-121,2396
3000
1,4086
-121,4919
3100
1,4382
-121,7388
3200
1,4669
-121,9805
3300
1,4949
-122,2170
3400
1,5221
-122,4486
3500
1,5486
-122,6754