
- •2.1.Углеводороды.
- •2.1.1.Алканы.
- •2.1.2.Циклоалканы.
- •Номенклатура
- •2.1.3.Алкены
- •2.1.4.Алкины
- •2.1.5.Алкадиены
- •2.1.6.Арены
- •2.2.Гидроксисоединения.
- •2.2.1.Одноатомные спирты.
- •2.2.2.Фенолы.
- •2.2.3.Простые эфиры.
- •Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
- •2.2.6.Двухатомные фенолы.
- •2.3.Оксосоединения.
- •Номенклатура карбонильных соединений.
- •2.4.Карбоновые кислоты
- •2.4.1.Особенности дикарбоновых кислот.
- •2.5.Функциональные производные карбоновых кислот.
- •2.6.Амины.
Часть.2. Углеводороды и монофункциональные органические соединения.
Органическая химия - это химия соединений углерода. Число известных органических веществ во много тысяч раз превосходит число соединений, образованных всеми другими элементами. По этой причине невозможно изучение каждого индивидуального соединения. Однако большинство органических соединений можно рассматривать как комбинацию углеводородного радикала с функциональной группой, причем углеводородная часть молекулы обычно в химической реакции не затрагивается. Функциональная группа – это атомы или группы атомов неуглеводородного характера, которые определяют химические свойства молекул. Химия большинства органических веществ определяется реакциями функциональных групп. Поэтому органические соединения можно классифицировать и изучать на основе функциональных групп, имеющихся в молекуле, что дает возможность охватить свойства огромного числа известных соединений.
2.1.Углеводороды.
Углеводороды - это соединения, содержащие в своем составе только атомы углерода и водорода. Углеводороды можно рассматривать как фундамент органической химии. В соответствии со строением углеродного скелета углеводороды делятся на алифатические (с открытой углеродной цепью) и циклические (с замкнутой углеродной цепью). В зависимости от типа связей между атомами углерода как алифатические, так и циклические углеводороды делятся на насыщенные, содержащие только σ-связи, ненасыщенные, содержащие как σ-связи, так и π - связи. К насыщенным углеводородам относятся алканы и циклоалканы.
2.1.1.Алканы.
Алканы, предельные углеводороды алифатического ряда, являются гомологами простейшего углеводорода метана и имеют общую формулу СnНn+2, причем каждый последующий член ряда отличается от предыдущего на группу СН2, называемую гомологической разностью. Каждый класс органических соединений характеризуется определенными особенностями и строением. В свою очередь от строения зависят химические и физические свойства. Следовательно, вещества, принадлежащие одному классу соединений, должны обладать многими общими и правильно изменяющимися при изменении состава физическими и химическими свойствами.
Номенклатура.
По систематической номенклатуре ИЮПАК первые четыре члена гомологического ряда - метан, этан, пропан и бутан имеют случайные названия. Начиная с пятого члена для углеводородов, имеющих нормальную, т.е. неразветвленную углеродную цепь, - это названия греческих числительных с добавлением окончания - ан .
Таблица
Названия нормальных алканов
Строение |
Название |
СH4 |
метан |
CH3-CH3 |
этан |
CH3 CH2 CH3 |
пропан |
CH3 (CH2)2 CH3 |
бутан |
CH3 (CH2)3 CH3 |
пентан |
CH3 (CH2)4 CH3 |
гексан |
CH3 (CH2)5 CH3 |
гептан |
CH3 (CH2)6 CH3 |
октан |
CH3 (CH2)7 СН3 |
нонан |
СН3 (СН2)8 CH3 |
декан |
Алканы с разветвленной цепью рассматриваются как производные нормальных алканов, в которых один или несколько атомов водорода замещены на углеводородные радикалы. Если у молекулы алкана отнять один атом водорода, то получается углеводородный радикал. Общая формула предельных углеводородных радикалов CnH2n+1 .Простейшие радикалы:

метил этил пропил изопропил
Чтобы назвать разветвленный углеводород, выбирают главную углеродную цепь, по возможности самую длинную и содержащую наибольшее число радикалов, иными словами, самую сложную. Все атомы углерода главной цепи нумеруют с того конца, ближе к которому находится заместитель. Название строится из перечисления названия углеводородных радикалов (в алфавитном порядке) с указанием номера атома углерода, при котором он находится, с добавлением названия углеводорода главной цепи, например:
2 -метил- 4 – этил - гексан
-метил- 4 – этил - гексан
Основной тип изомерии для алканов - это изомерия углеродного скелета. Начиная с C4H10, одной и той же молекулярной формуле соответствуют несколько алканов, различающихся строением углеродного скелета. Для бутана известны два изомера,
н -бутан
2-метилпропан,
-бутан
2-метилпропан,
для пентана - три, для гексана – 5, для С20Н42 - 366319 изомеров. Даже в углеводородах с нормальной цепью атомы углерода не располагаются по прямой, и цепь имеет следующий вид:
В таких системах поворот вокруг связи С - С совершается сравнительно легко, поэтому углеводородная цепь может принимать различные формы – конформации. Самой выгодной с энергетической точки зрения оказывается заторможенная конформация.
Физические свойства.
Связи углерод-углерод и углерод-водород неполярны и, следовательно, единственными силами, притягивающими молекулы друг к другу, являются слабые вандерваальсовы силы. В результате углеводороды имеют низкие температуры кипения и плавления по сравнению со многими другими соединениями, имеющими аналогичную молекулярную массу. Углеводороды следуют общему эмпирическому правилу ”подобное растворяет подобное” и растворимы в неполярных растворителях и нерастворимы в полярных, таких как вода.
Химические свойства алканов.
Алканы содержат только неполярные - связи, что обусловливает их малую реакционную способность. Они не взаимодействуют при обычных условиях с концентрированными растворами кислот и щелочей, на них не действует в темноте бром, они не обесцвечивают раствор перманганата калия. Прочность - связи и ее неполярность делают алканы очень устойчивыми в химическом отношении. Все реакции алканов протекают в достаточно жестких условиях (крекинг, сгорание) либо требуют участия очень реакционно-способных частиц, радикалов. Для алканов характерны реакции, протекающие с гомолитическим разрывом связи, т.е. радикальные реакции, а точнее, радикальное замещение (SR), где агентом реакции является свободный радикал. Радикал - частица, имеющая неспаренный электрон (Cl., СH3 ., NO2 .), либо молекула с двумя электронами, имеющими параллельные спины (молекула кислорода). Cвободные радикалы возникают при гомолитическом разрыве связи, при этом заряженных частиц не образуется. При гомолитическом расщеплении связи всегда затрачивается энергия. Эта энергия может приобретаться различными способами. Одним из способов расщепления - связи является использование тепловой энергии (термолиз). При t=500о большинство органических реакций протекает по радикальному механизму (пиролиз, крекинг-процесс), поскольку при таких процессах энергии достаточно для разрыва большинства связей. Есть вещества, для которых энергия расщепления, энергия диссоциации связи настолько мала, что уже при низких температурах происходит ее диссоциация. Так, в бензольном растворе до 1,5% гексафенилэтана диссоциировано на трифенилметильные радикалы. Такие легко образующиеся радикалы называются стабильными. Другой способ разрыва - связи - это ее расщепление при помощи лучистой энергии (фотолиз, радиолиз). Ультрафиолетовое облучение расщепляет большинство связей и приводит к образованию свободных радикалов. Последние могут быть получены и при окислительно-восстановительной реакции в водном растворе, например:
![]()
Такие процессы могут протекать и в организме и быть причиной многих патологических процессов. Как уже было сказано, свободные радикалы - это короткоживущие, реакционные частицы, имеющие неспаренный электрон. Стабильность радикала зависит от природы элемента, в первую очередь от его электроотрицательности, от характера заместителей в нем. Радикал тем устойчивее, чем меньше электроотрицательность атома, из которого он образован, например:
Л юбые
заместители, обладающие + I и + M эффектами,
повышают устойчивость свободного
радикала, например:
юбые
заместители, обладающие + I и + M эффектами,
повышают устойчивость свободного
радикала, например:
( CH3) 3 C - > (CH3)2CH - > CH3CH2 - > CH3 -
Особенно сильно повышают устойчивость радикалов заместители, проявляющие + М эффект. Поэтому наиболее устойчивы радикалы аллильного и бензильного типа:
C6H5-CH2 .> CH2=CH-CH2 .> (CH3)3C . > CH3-CH2- > CH3.> CH2=CH. > C6H5.
Предельные углеводороды вступают в реакции галогенирования и окисления. В этих реакциях затрагиваются преимущественно С-Н связи. Если радикал обладает достаточно высокой реакционной способностью, то он легко вступает в реакции замещения. Перенос радикальных свойств на другие молекулы может часто повторяться в определенной циклической последовательности, иными словами, носит цепной свободнорадикальный характер и называется реакцией радикального замещения.(SR). Алканы реагируют с галогенами (за исключением иода), образуя смеси галогеналканов. Например, при взаимодействии хлора с алканом атомы водорода углеводорода постепенно замещаются на атомы хлора, и, чем выше концентрация хлора, тем больше содержание полихлорированных углеводородов в смеси.
Реакция хлорирования метана до монохлорпроизводного описывается следующей схемой:
CH4 + Cl2 CH3Cl + HCl
Однако это уравнение отражает лишь суммарный итог процесса, который протекает через несколько элементарных стадий. Реакцию хлорирования проводят либо при нагревании (2500), либо при облучении ультрафиолетовым светом. В этих условиях связь в молекуле хлора разрывается гомолитически с образованием радикала хлора. Эта стадия называется стадией инициирования цепи.
1.Инициирование, возникновение свободного радикала:
h
Р![]() адикал
хлора является очень активной частицей,
которая атакует молекулу метана с
образованием HCl и радикала CH3..
Метильный радикал реагирует с новой
молекулой хлора, при этом образуется
метанхлорид и новый радикал хлора,
который может начать новый цикл таких
же реакций. Эта стадия носит название
стадии роста цепи.
адикал
хлора является очень активной частицей,
которая атакует молекулу метана с
образованием HCl и радикала CH3..
Метильный радикал реагирует с новой
молекулой хлора, при этом образуется
метанхлорид и новый радикал хлора,
который может начать новый цикл таких
же реакций. Эта стадия носит название
стадии роста цепи.
2.Рост цепи:
Cl.+ CH4 CH3. + HCl
CH3. + Cl2 CH3Cl + Cl. и т.д.
Реакция заканчивается стадией обрыва цепи в результате столкновений свободных радикалов. Это может произойти несколькими способами:
3.Обрыв цепи:
В общем случае, радикальные реакции
осуществляются только тогда, когда они
экзотермичны. Так как реакции проходят
через несколько элементарных стадий,
то некоторые стадии реакций могут быть
и эндотермичны, но общий суммарный
тепловой эффект реакции должен быть
положителен. Тепловой эффект реакции
определяется по закону Гесса как разность
энергий расщепляющейся (энергия
диссоциации) и образующейся связи.
Реакционная способность радикала
относительно данного субстрата тем
выше, чем больше энергии выделяется при
образовании новой связи, т.е. чем больше
энергия диссоциации этой связи. При
галогенировании алканов образуются
смеси продуктов галогенирования. В
алкане радикальной атаке подвергаются,
в первую очередь, третичные, затем
вторичные, а потом уже первичные связи.
Это связано с разницей в энергиях
диссоциации этих связей, которая
составляет, соответственно, 381, 393.5 и 406
кдж/моль. Поэтому преимущественно
получаются продукты галогенирования
по третичному атому, потом - по вторичному,
а затем уже по первичному атому углерода.
Из галогенов, которые используются для
получения галогенпроизводных, это хлор
и бром. Радикал фтор обладает настолько
высокой энергией, что реакция с фтором
протекает с взрывом и не находит
применения. Иод легко образует радикал,
но реакция иодирования является
эндотермической, т.е. иодирование в
радикальных условиях осуществить не
удается, другими словами, иод - ингибитор
цепных реакций. Радикал хлор обладает
настолько высокой энергией, что атакует
любую C-H связь (первичную, вторичную или
третичную), что приводит к получению
смеси продуктов хлорирования. В отличие
от хлора, радикал бром менее активен, и
при бромировании атакуются исключительно
третичные связи. Так, при радикальном
бромировании 2-метилпропана получается
исключительно трет.бромистый бутил.
общем случае, радикальные реакции
осуществляются только тогда, когда они
экзотермичны. Так как реакции проходят
через несколько элементарных стадий,
то некоторые стадии реакций могут быть
и эндотермичны, но общий суммарный
тепловой эффект реакции должен быть
положителен. Тепловой эффект реакции
определяется по закону Гесса как разность
энергий расщепляющейся (энергия
диссоциации) и образующейся связи.
Реакционная способность радикала
относительно данного субстрата тем
выше, чем больше энергии выделяется при
образовании новой связи, т.е. чем больше
энергия диссоциации этой связи. При
галогенировании алканов образуются
смеси продуктов галогенирования. В
алкане радикальной атаке подвергаются,
в первую очередь, третичные, затем
вторичные, а потом уже первичные связи.
Это связано с разницей в энергиях
диссоциации этих связей, которая
составляет, соответственно, 381, 393.5 и 406
кдж/моль. Поэтому преимущественно
получаются продукты галогенирования
по третичному атому, потом - по вторичному,
а затем уже по первичному атому углерода.
Из галогенов, которые используются для
получения галогенпроизводных, это хлор
и бром. Радикал фтор обладает настолько
высокой энергией, что реакция с фтором
протекает с взрывом и не находит
применения. Иод легко образует радикал,
но реакция иодирования является
эндотермической, т.е. иодирование в
радикальных условиях осуществить не
удается, другими словами, иод - ингибитор
цепных реакций. Радикал хлор обладает
настолько высокой энергией, что атакует
любую C-H связь (первичную, вторичную или
третичную), что приводит к получению
смеси продуктов хлорирования. В отличие
от хлора, радикал бром менее активен, и
при бромировании атакуются исключительно
третичные связи. Так, при радикальном
бромировании 2-метилпропана получается
исключительно трет.бромистый бутил.
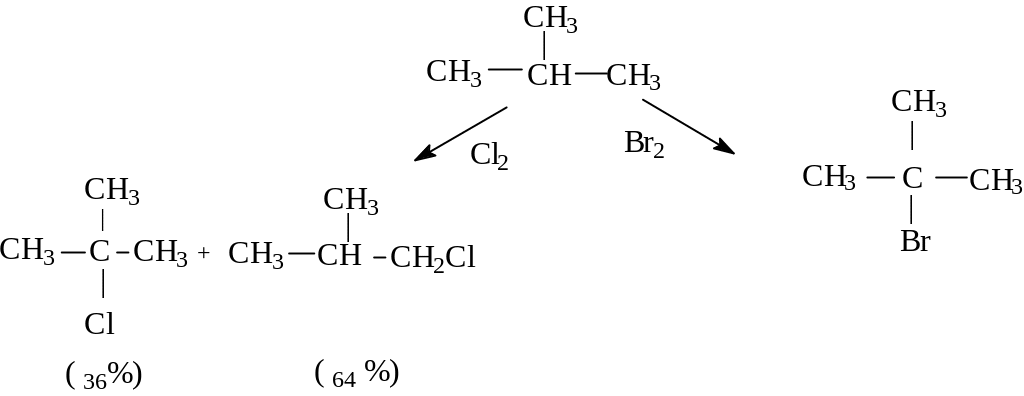
Реакции 2-метилпропана с хлором и бромом
Другой важной радикальной реакцией углеводородов является реакция окисления кислородом (реакция аутоокисления). Кислород, будучи радикальной молекулой, может реагировать по радикальному механизму, атакуя С-Н связи углеводорода. В первую очередь, кислород атакует третичный атом углерода, при этом образуются гидропероксиды. Для инициирования радикальных реакций часто используют вещества, которые легко образуют свободные радикалы. К таким веществам относятся алкил - и ацилпероксиды, энергия диссоциации связи в которых незначительна и при небольшом нагревании они легко распадаются на радикалы, например:

Такие вещества называют промоторами цепных реакций. Есть вещества, которые способны, наоборот, останавливать цепные реакции. Это ингибиторы. К ним относятся иод, фенол, гидрохинон и др. При взаимодействии этих веществ с радикалом происходит передача радикальных свойств, но вновь образованные радикалы обладают малой реакционной способностью из-за большой делокализации неспаренного электрона.
В заключение надо отметить, что радикалы могут образовываться в живом организме и быть причиной многих патологических процессов, поэтому выяснение механизма радикальных реакций является предметом изучения медицины и биологии. К таким проблемам относится изучение воздействия облучения на живой организм, измерение концентрации свободных радикалов и сопоставление ее с канцерогенной активностью некоторых органических веществ, пероксидное окисление липидов, некоторые ферментативные реакции, и, наконец, проблема фотосинтеза.
