
Флуориметрические методы
Определение с салицилаль-о-аминофенолом
Максимум интенсивности флуоресценции комплекс алюминия с реагентом наблюдается при рН = 5,8 и длине волны 580 нм. Состав флуоресцирующего комплекса алюминия с реагентом 1:2. Молярный коэффициент поглощения составляет 9200. Чувствительность данного метода составляет 0,0025 мг/л. Верхняя граница определяемых концентраций – 0,1 мг/л. Флуоресценция достигает максимума через 15 минут после начала реакции и в дальнейшем остается постоянной. Реагент применяют в виде раствора в ацетоне. Определению не мешают малые количества - до 0,7 мг/л - Fe(III) и Сu(II). Большие количества Fe(III) и Сu(II) гасят флуоресценцию, в этом случае алюминий определяют методом добавок. Некоторые авторы для увеличения чувствительности и селективности определения предлагают экстрагировать комплекс алюминия изоамиловым спиртом. Воспроизводимость метода 2-5% [1].
Методы атомно-абсорбционного спектрального анализа
Атомы алюминия поглощают световое излучение, длина волны которого составляет 309,3 нм. Так как в атомно-абсорбционной спектроскопии используются источники света с высокой монохромотичностью резонансного излучения, то в данном методе не стоит проблемы низкой селективности и необходимости маскирования мешающих ионов. Анализ проводится по методу градуировочного графика. В ходе анализа используется электротермическая атомизация. Диапазон определяемых концентраций: 0,005 - 0,1 мг/л. При анализе проб с массовой концентрацией металла, превышающей верхний предел указанного диапазона, производят соответствующее разбавление. Воспроизводимость 2-10 % [5,6].
Титриметрические методы
Комплексометрическое титрование
В качестве реагента используется комплексон III – двунатриевая соль этилендиаминтетрауксусной кислоты:
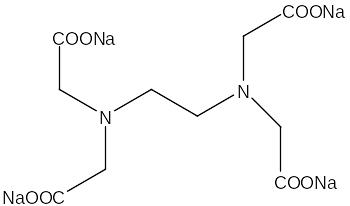
Алюминий и комплексон входят в комплекс в соотношении 2:1. Комплексонат алюминия достаточно прочное соединение. Однако, несмотря на это процесс его образования протекает довольно медленно. Это объясняется склонностью алюминия к образованию гидратированного иона [Al(H2O)6]3+. При нагревании до кипения скорость образования комплекса значительно возрастает. Поэтому при анализе обычно используется обратное титрование. Для этого в раствор сначала добавляют избыток комплексона III и кипятят его для количественного быстрого перехода алюминия в форму комплекса. Затем раствор охлаждают, добавляют индикатор и титруют раствором цинка до изменения окраски. В качестве индикатора чаще всего используют ксиленоловый оранжевый или метилтимоловый синий. Оптимальное значение рН = 5,5, при меньших значениях рН переход окраски менее четкий. Цинк образует более прочный комплекс с натриевой солью ЭДТА чем алюминий. Определению мешает присутствие Fe(II), поэтому его предварительно окисляют азотной кислотой или персульфатом аммония. Так же в той или иной степени мешают ионы многих металлов. Нижняя граница определяемых концентраций 1мг/л. По этому параметру все титриметрические методы несомненно проигрывают представленным выше фотометрическим и атомно-абсорбционным методикам. Воспроизводимость сильно зависит от визуального фиксирования точки конца титрования и может достигать 20 % [1,6].
Определение с оксихинолином
Метод основан на осаждении оксихинолината алюминия, растворении последнего в кислоте и броматометрическом определении связанного оксихинолина. Использование титриметрии значительно сокращает продолжительность анализа по сравнению с гравиметрической методикой, основанной на той же реакции. Использование на последнем этапе иодометрии позволяет получить достаточно высокую точность. Определению мешает присутствие ионов Fe(III), он должен быть переведен в форму Fe(II). Это достигается путем добавления сульфидов или сульфитов [1].
