
- •1. Тиск газів. Закон Паскаля. Атмосферний тиск
- •2. Послідовне та паралельне з’єднання провідників в електричному колі.
- •3. Рівноприскорений рух. Вільне падіння .
- •4. Взаємодія струмів. Магнітне поле струму. Магнітна індукція. Сила Ампера. Сила Лоренца.
- •5. Механічний рух. Відносність руху. Система відліку. Шлях і переміщення. Додавання швидкостей.
- •6. Випаровування рідин. Насичуюча і ненасичуюча пара. Тиск насичуючої пари. Вологість повітря, її вимірювання
- •7. Рівномірний рух тіла по колу
- •8. Електромагнітні хвилі, їх випромінювання. Принципи сучасного радіозв’язку. Розвиток засобів зв’язку в Україні.
- •9. Гравітаційна взаємодія. Закон всесвітнього тяжіння. Деформація тіл. Закон Гука. Сила тертя.
- •10. Корпускулярно-хвильовий дуалізм. Тиск світла. Дослід Лебедєва. Хімічна дія світла.
- •11. Перший закон динаміки Ньютона. Інерціальні системи відліку. Принцип відносності у класичній механіці.
- •12. Закони відбивання та заломлення світла.
- •13. Маса, її вимірювання. Сила. Другий закон динаміки Ньютона.
- •14. Радіоактивність. Закон радіоактивного розпаду. Альфа-, бета-, гамма-випромінювання.
- •15. Третій закон Ньютона. Імпульс тіла. Закон збереження імпульсу. Значення робіт к. Ціолковського, ю. Кондратюка, с.Корольова у розвитку космонавтики.
- •16. Самоіндукція. Індуктивність. Енергія магнітного поля.
- •17. Рух тіла під дією кількох сил. Момент сили. .
- •18.Неперервний та лінійчатий спектри. Спектри поглинання та випромінювання. Спектральний аналіз та його застосування.
- •19. Фотоелементи та їх застосування в техніці.
- •20. Дифракція світла. Дифракційна решітка та її застосування
- •21. Склад атомного ядра. Відкриття нейтрона. Ізотопи
- •22. Генератор змінного струму. Трансформатор. Передавання енергії на відстань.
- •23. Основні положення молекулярно-кінетичної теорії. Пояснення агрегатних станів речовини на основі мкт. Маса і розмір молекул. Стала Авогадро.
- •Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів.
- •Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим.
- •24. Лінзи. Формула тонкої Лінзи. Лінійне збільшення
- •25. Внутрішня енергія, способи її зміни. Кількість теплоти та робота. Перший закон термодинаміки
- •26. Вільні електромагнітні коливання у контурі. Перетворення енергії в коливальному контурі. Власна частота коливань у контурі
- •27. Температура, її фізичний зміст. Вимірювання температури. Температурні шкали.
- •28. Поділ ядер урану. Ланцюгова реакція. Ядерний реактор. Термоядерні реакції
- •29. Несамостійний і самостійний розряди у газах. Плазма, її використання.
- •30. Дослід Резерфорда. Ядерна модель атома. Квантові постулати Бора.
- •31. Електризація тіл. Електричний заряд, його дискретність. Закон збереження електричного заряду. Закон Кулона.
- •32. З'єднання конденсаторів у батарею.
- •33. . Електричне поле. Напруженість електричного поля. Лінії напруженості
- •34 Фотоелектричний ефект. Закони фотоефекту, їх пояснення на основі квантових уявлень. Рівняння Ейнштейна.
- •35. Робота при переміщенні заряджених тіл в електричному полі. Потенціал. Різниця потенціалів. Напруга.
- •36. Експериментальні методи реєстрації іонізуючих випромінювань. Поглинена доза випромінювання, її біологічна дія. Способи захисту від випромінювання
- •37. Електроємність. Конденсатор. Енергія електричного поля конденсатора (без виведення). Застосування конденсаторів у техніці.
- •38. Деформації. Види деформацій. Сила пружності. Закон Гука
- •39. Електричний струм. Закон Ома для ділянки кола. Опір.
- •40. Кристалічні та аморфні тіла. Поняття про рідкі кристали
- •41. Електрорушійна сила. Закон Ома для повного кола. Робота і потужність електричного струму.
- •42. Природа світла
- •43. Явище електромагнітної індукції. Закон електромагнітної індукції. Правило Ленца.
- •44. Побудова зображення за допомогою лінзи.
- •45. Електромагнітне поле, його матеріальність. Електромагнітні хвилі, їх властивості. Радіолокація, її застосування.
- •Блок-схема радіолокаційної станції.
- •46 Поверхневий натяг. Капілярні явища. Явища змочування і капілярності у природі і техніці.
- •47. Електричний струм у вакуумі. Електронна емісія. Електронно-променева трубка.
- •48. Ідеальний газ. Рівняння стану ідеального газу.
- •49. Електричний струм в електролітах. Закони електролізу. Застосування електролізу.
- •50. Шкала електромагнітних хвиль. Застосування інфрачервоного, ультрафіолетового та рентгенівського випромінювань.
- •51. Електричний струм у напівпровідниках. Залежність опору напівпровідників від температури та освітленості. Застосування напівпровідників.
- •52. Когерентність. Інтерференція, її застосування в техніці. Дисперсія світла.
23. Основні положення молекулярно-кінетичної теорії. Пояснення агрегатних станів речовини на основі мкт. Маса і розмір молекул. Стала Авогадро.
Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів.
Підтвердженням дискретності є прокатка, кування металу, отримання 1974 року фотографії окремих молекул і атомів, розчинність речовин тощо.
Молекули - найменші частинки, які мають хімічні властивості речовини. Молекули складаються з більш простих частинок - атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 105 елементів.
Речовину, яка побудована з атомів лише одного виду, називають елементом (водень, кисень, азот тощо). Кожен елемент має свій номер Z в таблиці Менделєєва. Число Z визначає кількість протонів у ядрах атомів і електронів, що рухаються в атомі навколо ядра.
Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих - відштовхуються. Сили притягання і відштовхування між молекулами діють постійно.
Більшість молекул
неорганічних речовин мають діаметр
d ![]() 10-10 м
і m = 10-26 кг.
Гігантами є молекули білків. Характерний
розмір молекули дезоксирибонуклеїнової
кислоти (ДНК), наприклад, досягає кількох
сантиметрів.
10-10 м
і m = 10-26 кг.
Гігантами є молекули білків. Характерний
розмір молекули дезоксирибонуклеїнової
кислоти (ДНК), наприклад, досягає кількох
сантиметрів.
Маси молекул виражаються малими і незручними для розрахунків числами. Тому як еталон для порівняння використовують спеціальну одиницю - атомну одиницю маси (а.о.м.): за атомну одиницю маси приймають 1/12 долю маси атома вуглецю. Маси всіх атомів і молекул порівнюють з атомною одиницею маси.
Відносною молекулярною (або атомною) масою речовини (Мr) називається відношення маси молекули (або атома) даної речовини (то) до 1/12 мас атома вуглецю (moc):

A а.o.м. = mос/12 = 1,66* 10-27 кг). Відносна молекулярна маса — величина безрозмірна.
Чим більше атомів або молекул в телі, тим більше речовини міститься у ньому. Число молекул в макроскопічному телі величезно. Тому зручно вказувати не абсолютне число атомів і молекул, а відносне. Прийнято порівнювати число молекул або атомів в даному телі з числом атомів в 0,012 кг вуглецю.
Моль дорівнює кількості речовини системи, що містить стільки ж часток (атомів, молекул), скільки міститься атомів в 0,012 кг карбону12. Таке число молекул називається числом Авогадро і дорівнює
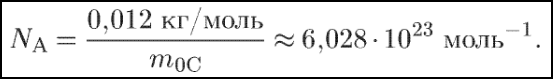
Таким чином, число Авогадро визначає кількість молекул в одному молі речовини. Одиниця кількості речовини — моль — входить до числа основних одиниць системи СІ ( поряд з кг, м, с).
Маса одного моля речовини дорівнює
![]()
Де m0- масса однієї молекули речовини, NA-число Авогадро
Число молекул в довільній масі речовини m можна визначити через число Авогадро
![]()
![]() —
число
молей в даній масі газу. Число молей
можна знайти таким чином:
—
число
молей в даній масі газу. Число молей
можна знайти таким чином:
![]()
З урахаванням цього


При вивченні властивостей газу за допомогою експериментів було встановлено, що один моль будь-якого газу при нормальних умовах має об'ем 22,4*10-3 м3 , чи 22,4л. Цей результату повній відповідності з відомим хімічним законом Авогадро: у рівних обвній відповідності з відомим хімічним законом Авогадро: у рівних об'мах різних газів при однакових температурах та тиску міститься однакове число молекул.
Число молекул газу в одиниці об'єму при нормальних умовах називається сталою Лошмідта та позначається nл
nл=2,7*1025 молекул/м3
Агрегатні стани речовини
Відомо, що одна й та ж речовина залежно від умов може перебувати у твердому, рідкому чи газоподібному станах. Яскравим прикладом е лід, вода і пара.
Рідкий, твердий і газоподібний стани речовини називаються агрегатними станами.
У різних агрегатних станах молекули однієї і тієї ж речовини однакові, складаються з одних і тих же атомів. Хоча молекули рідин, газів і твердих тіл рухаються безладно, проте характер руху, розташування і взаємодія молекул різні, цим і пояснюється існування трьох агрегатних станів речовини.
Відстані між молекулами газів значно перевищують розміри самих молекул, тому сили взаємодії між ними малі, молекули рухаються поступально від зіткнення до зіткнення з іншими молекулами. Цим визначається те, що гази леткі (займають весь наданий їм об'єм), легко стискуються.
У рідинах частинки перебувають ближче одна до одної, ніж у газах, тому вони сильніше взаємодіють і не можуть далеко відійти одна від одної, а лише коливаються відносно певних положень, перестрибуючи з одного положення в інше. Тому рідини течуть, набувають форми посудини, зберігають свій об'єм, їх важко стискувати.
У твердих тілах молекули чи атоми під час теплового руху майже не переміщуються з місця на місце: вони коливаються відносно деяких середніх положень. У будові твердих тіл простежується чіткий порядок. Сили взаємодії втримують частини у вузлах кристалічної решітки. Така будова зумовлює багато важливих властивостей твердих тіл: збереження форми й об'єму, малу стисливість тощо.
