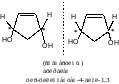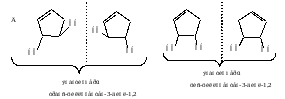Решение
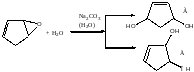
М (А) = 2 г/моль * 33 = 66 г/моль υ(С) = 66 г * 0,909 : 12 г/моль = 5 моль υ(Н) = 66 г * 0,091 : 1 г/моль = 6 моль Формула А: С5Н6 |
1 балл |
При взаимодействии А с металлическим натрием образуется соединение, обладающее свойствами соли, в котором анион ароматичен, следовательно система циклическая и содержит сопряженные π-связи с числом π-электронов 4n+2
|
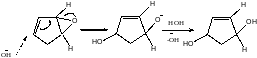
За каждую структурную формулу по 1 баллу (итого 5 баллов)
За каждое уравнение по 1 баллу (итого 3 балла)
|
Механизм: Na2CO3 + H2O NaHCO3 + NaOH
|
За каждый механизм по 2 балла (итого 4 балла) |
|
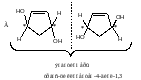
По 1 баллу за каждый стереоизомер с названием (итого 7 баллов) |
Итого: |
20 баллов |
Задача 4. (авторы Меньшиков В.В., Шлапаков Н.)
Пояснение: в задаче ни один из символов, выделенных жирным шрифтом, не является символом химического элемента.
В отходящих газах Астраханских нефтяных месторождений содержится 10 % газа А. При взаимодействии этого газа с газом В в присутствии катализаторов на основе оксидов железа и алюминия образуется простое вещество Х. Газом В в промышленности осаждают простое вещество Y из раствора Y-содержащей кислоты, где Y находится в промежуточной степени окисления.
X и Y – представители одной группы. При сплавлении Y со щелочью на воздухе образуется натриевая соль кислоты С, способной растворять благородный металл Z с образованием оксосоли Z1.
Газ В, реагируя с бурым газом D в присутствии воды, образует сильную кислоту Е.
Х диспропорционирует при его кипячении в растворе едкого натра с образованием солей O и Q, примерное содержание Х в соли О больше, чем в соли Q.
Х реагирует с металлами. Обычно синтез проводят при нагревании, но с одним из металлов (W) реакция протекает при комнатной температуре с образованием вещества W1 красного цвета.
При сжигании Y в атмосфере бурого газа D образуется вещество G с запахом «гнилой редьки» и со степенью окисления Y такой же, что и в кислоте Y1. Вещество G также образуется при взаимодействии ангидрида кислоты С с красным фосфором
Газ В, реагируя с цинком, образует соль I, которую по реакции с кальцинированной содой переводят в натриевую соль I1, способную восстанавливать азобензол до анилина. При нагревании I1 образуется газ В, соль Q и соль J, которую также можно получить, одновременно пропуская А и В через раствор едкого натра. Соль J окисляется галогенами, но, к примеру, йодом и хлором она окисляется по разному. Анион соли J – отличный лиганд, способный перевести в раствор нерастворимый в воде бромид благородного металла Z2, находящийся в одной группе с металлом Z. Соль J образует с этим бромидом комплексное соединение Z3, разлагающееся при действии концентрированной кислоты Е на В1Х1 натриевую соль кислоты Е, водород и соль, содержащую 12,938% Х (Z4).
При нагревании J разлагается на две другие соли, одна из которых – К - содержит 87,458% Х. Соль J также реагирует с веществом Х1, образующимся при исчерпывающем хлорировании Х газообразным хлором. После взаимодействия J с Х1 образуется поваренная соль и соль L, анион которой содержит 62,544% Х.
1) Определите все зашифрованные вещества.
2) Составьте уравнения всех описанных реакций.
3) Нарисуйте структуру комплексного иона в Z3.