
2. Методы опреснения и обессоливания воды.
Методы опреснения и обессоливания воды подразделяются на две основные группы: с изменением и без изменения агрегатного состояния. К первой группе относятся дистилляция, замораживание и др. методы, ко второй - ионообмен, электродиализ, обратный осмос (гиперфильтрация) и др. На АЭС находят применение дистилляция, ионный обмен, электродиализ и другие.
Выбор метода обуславливается качеством исходной воды, требованием к качеству очищенной воды, производительностью установки и технико-экономическими соображениями.
Очистка воды методом дистилляции. Дистилляция - процесс подогрева водного раствора до кипения, отбора образующегося водяного, пара и его конденсации. Полученный конденсат водяного пара называют дистиллятом (дистиллированной водой). Если процесс дистилляции повторить, то получим бидистиллят.
Дистилляция - традиционный и самый распространенный способ опреснения воды, этим методом получают 96 % всей опресняемой в мире волы. Моряками он применяется еще со времен древней Греции и в настоящее время продолжает оставаться основным источником пресной воды на морских кораблях.
Дистилляция используется для очистки воды от любых загрязнений (взвешенных и растворенных), кроме летучих и газообразных. Этот метод используется для опреснения воды с большой степенью минерализации (морская вода) и для воды загрязненной вредными веществами, которую нельзя сбрасывать в естественные источники.
На АЭС испарительные установки в основном применяют в установках спецводоочистки: СВО-3, СВО-6, СВО-7.
Для производства воды заполнения контуров ЯЭУ и их подпитки из природной воды на отечественных АЭС испарительные установки не применяют исходя из технико-экономических соображений.
Очистка воды методом вымораживания. Вымораживание - метод опреснения воды, заключающийся в охлаждении соленой воды ниже температуры замерзания, отделении образовавшегося льда и последующем его плавлении. Концентрация растворенных веществ в воде при этом значительно снижается, однако существующие методы нагрева и разработанные на их основе конструкции дистилляторов значительно экономичнее рефрижераторных установок и опреснителей на их основе. Поэтому метод вымораживания не нашел широкого применения и используется в основном там, где есть естественные источники холода. Этим методом получают всего 0,1 % мирового производства опресненной воды.
Электродиализ. Электродиализ - процесс удаления из растворов (проводников второго рода) ионизированных веществ путем переноса их через мембраны в поле постоянного электрического тока. В такой системе возникает направленное движение ионов Н+ и ОН- , причем катионы движутся к катоду, а анионы - к аноду, при этом электродиализатор разделяют на отсеки с помощью специальных мембран, катионопроницаемые и анионопроницаемые мембраны. При этом катионопроницаемые мембраны пропускают катионы и не пропускают анионы, а анионопроницаемые мембраны наоборот пропускают анионы и не пропускают катионы.
Принцип работы виден из функциональной схемы электродиализатора:
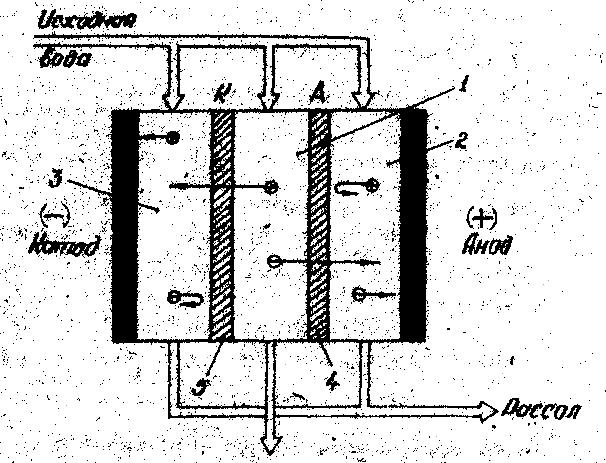
Обессоленная вода
Ионитные мембраны для процессов электродиализа должны обладать высокой селективностью, малой проницаемостью, химической стойкостью, хорошей электрической проводимостью, высокой механической прочностью, определяющей продолжительный срок службы в промышленных условиях.
Внедрение электродиализа началось более 20 лет назад, но широкое использование его тормозится необходимостью предварительной очистки воды от взвешенных и коллоидных частиц, которые могут осаждаться на мембранах и ухудшать их проницаемость. Возможно "отравление" мембран органическими примесями, что ухудшает их работу и приводит к "образованию кальциевых и магниевых отложений. Сдерживают применение электродиализа также сложность аппаратуры и высокие эксплуатационные расходы по замене мембран.
Электродиализ выгодно использовать для опреснения соленых вод, так как удельные затраты на удаление солей снижаются с ростом минерализации исходной воды. В настоящее время этим методом получается около 3 % всей опресняемой воды.
Метод обратного осмоса. Метод деминерализации воды обратным осмосом (гиперфильтрация) основан на прохождении чистого растворителя через полупроницаемую мембрану при давлении, превышающем осмотическое. Движущей силой этого процесса является разность между приложенным и осмотическим давлениями:
![]()
Где: р - избыточное давление над исходным раствором;
![]() - осмотическое
давление соответственно исходного
раствора и раствора, прошедшего через
мембрану.
- осмотическое
давление соответственно исходного
раствора и раствора, прошедшего через
мембрану.
Эффективность процессов обратного осмоса в значительной степени определяется свойствами применяемых мембран, которые должны отвечать следующим требованиям: высокой разделяющей способностью (селективностью), высокой удельной проницаемостью, устойчивостью к воздействию среды, неизменностью характеристик в процессе эксплуатации, достаточной механической прочностью, низкой стоимостью.
Обратным осмосом сейчас получают всего 1 % всей опресняемой воды в мире, хотя считается, что это один из наиболее перспективных и экономичных способов опреснения. Сдерживает широкое применение этого метода отсутствие долговечных мембран.
Метод ионного обмена. Основан на явлении обмена ионов при контакте некоторых твердых веществ с растворами. В настоящее время на практике используется большое число как природных ионообменных веществ, так и искусственных ионитов различного состава.
Иониты - это нерастворимые в воде органические или неорганические вещества, содержащие активные группы с подвижными ионами и способные обменивать эти ионы на ионы растворов при контакте с ними.
Активные группы в ионитах - это функциональные группы кислотного или основного характера, которые присоединены к высокомолекулярному каркасу или матрице, причем иониты с однотипными функциональными группами называют монофункциональными, а с обменными группами различной природы - полифункциональными.
Используют органические иониты (крахмал, мелатин, целлюлозу, торф, древесину, наиболее широко - синтетические ионообменные смолы и сульфированные угли) и неорганические иониты - гидроксиды алюминия, железа бария, цеолиты, пермутиты.
На АЭС наиболее широко используют синтетические ионообменные смолы.
Наиболее часто в качестве катионита применяют катионит марки КУ-2-8 (катионит универсальный). Если после цифры 8 стоит буква ч – чистый, если чс – химически чистый ( 1 и 2 сорт ). Катионит марки КУ-2-8 стоек к разбавленным кислотам и щелочам, обладает высокой механической прочностью, термостойкостью ( до 1200С в Н-форме ). Его селективность очень высока к ионам Са2+ , Fe3+ , Ni2+ , Zn2+. Выпускается в виде сферических зерен размером 0,315 – 1,25 мм, цвет от желтого до темнокоричневого в Н+ форме.
Из анионитов наиболее широко применяется для очистки воды анионит АВ-17-8 (анионит высокоосновной), также как и катионит может быть особо чистым. Выпускается в виде сферических зерен размером 0,315 – 1,25 мм, цвет от желтого до темнокоричневого в ОН- форме. Термически устойчив до 600С.
Обработка воды методом ионного обмена экономически выгодна при солесодержании воды, не превышающем 1 г/кг. В противном случае ионообменные смолы быстро истощаются. Замена фильтрующего материала ввиду большой стоимости ионитов обходится дорого, а регенерация приводит к появлению большого количества вод, требующих нейтрализации.
При написании химических реакций иониты обозначаются в виде RH+ и ROH-, где R – сложный органический радикал катионита или анионита.
Процесс обработки воды с помощью катионитов называют катионированием, с помощью анионитов – анионированием. Обработка воды может производиться как при раздельной загрузке ионитов в корпуса фильтров, так и при совместной ( ФСД ).
При раздельной загрузке ионитов первым этапом очистки является катионирование. При этом реакции ионного обмена протекают по уравнениям типа:
а)
катионирование - RH+
+ Na+Cl-
![]() R
Na+
+ H+
Cl-
R
Na+
+ H+
Cl-
б) анионирование - ROH- + H+ Cl- R Cl- + Н2О
Таким образом, при последовательном катионировании и анионировании получается вода с очень малым содержанием солей.
Если процесс обессоливания воды на ионитных фильтрах длится достаточно долго, то иониты насыщаются и перестают поглощать ионы из растворов. В фильтрате появляются посторонние ионы, Этот момент называется проскоком ионов через фильтр, при чем в первую очередь будут проскакивать ионы стоящие в конце ряда интенсивности поглощений ионов. Интенсивность поглощений катионов зависит от их природы, ее можно представить следующим рядом:
Са+
![]() Мg2+
К+
NH4+
Na+
H+
Мg2+
К+
NH4+
Na+
H+
Каждый предыдущий ион в этом ряду будет вытеснять последующий, если они присутствуют в воде в сопоставимых концентрациях.
Интенсивность поглощений анионов можно представить в следующем виде:
SO4-2 Cl- NO3- HCO3- OH-
В системах обессоливания природных вод Н-катионитные фильтры отключаются на регенерацию по проскоку натрия и регенерируются обычно 1-5% раствором Н2SO4. Процесс регенерации завершается отмывкой фильтра,
Необходимой для удаления из межзерного пространства слоя остатков регенерационного раствора и продуктов регенерации.
Аонитные фильтры, как правило, выводятся на регенерацию по проскоку хлоридов и регенерируются щелочью NаОН.
При длительной работе фильтров также увеличивается гидравлическое сопротивление их загрузки. Поэтому при увеличении перепада давления на фильтре до предельных значений фильтр должен быть выведен на регенерацию.
В некоторых очистительных установках ЯЭУ ( БОУ ) используют смешанную загрузку фильтров при соотношении катионита и анионита от 1:1 до 3:1. Смешанная загрузка ионитных фильтров обладает рядом преемуществ перед раздельной загрузкой фильтров: - процессы поглощения ионов протекают практически одновременно, что приводит к ускорению обмена; - при смешивании иониты занимают объем значительно превосходящий суммарный объем ингредиентов смеси, и образуют более проницаемый слой, что позволяет вести процесс с большей эффективностью при скоростях в 2-3 раза больших, чем скорость, чем скорость при раздельном ионировании.
К основным показателям качества ионитов относят:
Полная обменная емкость - это общее число всех ионообменных групп в единице объема ионита, выражающееся в мг-экв/л. Полная обменная емкость постоянна для данного ионита и зависит только от термического, химического и ионизирующего воздействия. Из-за необходимости многократной регенерации ионитов их обменная емкость используется лишь частично. В таком случае вводится понятие рабочей обменной емкости ионитов, которая зависит от условий сорбции и регенерации ионитов. Для катионитов обменные емкости определяют по катионам, для анионитов - по анионам.
Сорбционная способность - это способность к избирательной сорбции ионов. Для оценки избирательной сорбционной способности ионитов определяют обменный коэффициент распределения К. При очистке раствора от ионов во время достижения равновесия эти ионы распределяются между ионитом и раствором. Отношение концентрации сорбируемого вещества в ионите к концентрации его в растворе при достижении равновесия и называется обменным коэффициентом распределения К. При К < 1 ионит обеднен по сравнению с раствором, а при К >1 обогащен ионами.
Коэффициент селективности определяет избирательность ионитов к тому или иному иону при прочих равных условиях. При этих условиях для определенных ионитов устанавливаются ряды селективности. Так, селективность катионита КУ-2 очень высока к ионам Са2+, Fe3+, Ni2+, Zn2+, что успешно используется в процессах водоподготовки.
Динамическая обменная емкость ДОЕ - количество ионов, которое может поглотить ионит до момента проскока поглощаемого компонента в динамических условиях. ДОЕ выражается в мг-экв поглощенного иона на 1 л ионита (мг-экв/л).
ДОЕ определяется по формуле:
ДОЕ
=
![]()
где С - концентрация ионов (катионов для катионита или анионов для
анионита) в воде, мг-экв/л;
V - количество воды, пропущенной через фильтр до проскока поглощаемого иона, л;
V1 - объем ионита, л.
ДОЕ является величиной переменной зависящей от ряда факторов:
- природы поглощаемого иона (например, емкость катионита по иону Na* меньше, чем по ионам Са2+ и Mg +);
- концентрации поглощаемого иона и рН раствора (с уменьшением концентрации ДОЕ снижается);
- скорости фильтрации (с увеличением скорости ДОЕ уменьшается);
- температуры фильтруемой воды.
Химическая стойкость - нерастворимость и способность ионита и сохранять обменную емкость в воде и растворах кислот, щелочей и солей
Термическая стойкость - нерастворимость и способность ионита при заданных температурах сохранять обменную емкость.
При повышении температуры фильтруемой воды некоторые иониты частично разлагаются и ДОЕ уменьшается. Продукты разложения анионита, содержащие аминогруппы и обладающие поэтому слабощелочными свойствами, могут поглощаться катионитом. В результате этого ДОЕ смеси катионита и анионита с повышением температуры воды понижается. При повышении температуры выше допустимых значений может происходить разрушение ионитов с полной потерей ДОЕ и загрязнением воды продуктами paзложения.( Для анионитов предельная температура – 600С, а для катионитов - 1200С.)
Радиационная стойкость - способность сохранять ДОЕ под воздействием радиации.
С увеличением радиации ДОЕ уменьшается за счет образования дополнительных сшивок. Кроме того, может происходить и разрушение (деструкция) полимерной основы ионитов. Аниониты менее радиационио стойки, чем катиониты.
Механическая прочность - способность сохранять свой гранулометрический состав (зернение) при эксплуатации (не истираться, не растрескиваться, не образовывать измельченной смеси в процессе работы).
Набухаемость - способность ионита увеличивать свой объем при контакте с водой.
