
Глава 2.
Виды кристаллов.
«...Есть кристаллы огромные, как колоннада храма, нежные, как плесень, острые, как шипы; чистые, лазурные, зеленые, огненные, черные; математически точные, совершенные, похожие на конструкции сумасбродных, капризных ученых... Есть кристаллические пещеры, чудовищные пузыри минеральной массы... И в человеке таится сила кристаллизации...»
Карел Чапек «Записки из Англии»
Всестороннее изучение сил связи в кристаллах привело к убеждению, что все кристаллы можно отнести к четырём основным видам: ионным, молекулярным, атомным и металлическим. Рассмотрим каждый из этих видов кристаллов подробнее.
2.1 Атомная кристаллическая решетка.
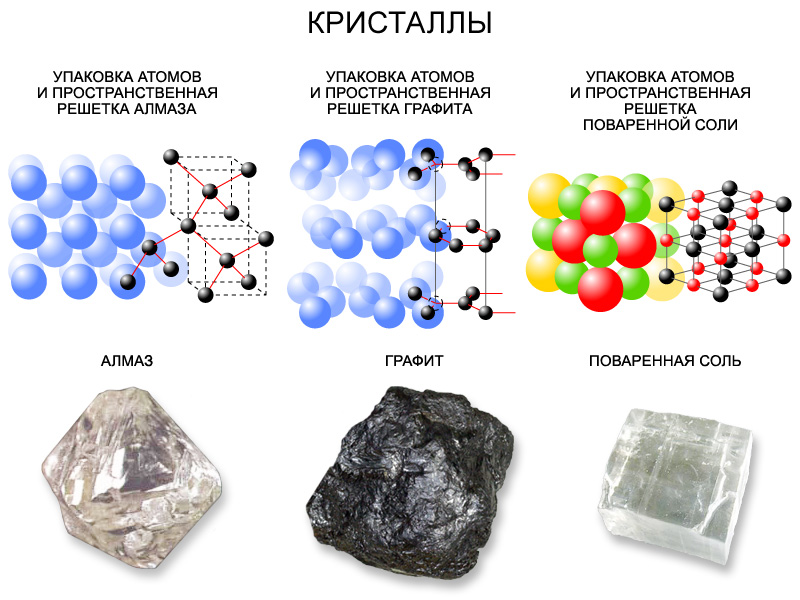
В узлах кристаллической решетки имеются атомы, связанные между собой ковалентными связями, т. е. общими электронными парами. В основе ковалентной связи между атомами лежит «спаривание» их внешних электронов с образованием полностью заполненной валентной электронной оболочки. Ковалентные связи в кристаллах - наиболее сильные. Поэтому атомные кристаллы, которым соответствует такая связь, обладают большой твёрдостью, высокой температурой плавления, нерастворимы в воде, не имеют запаха, что видно на примере алмаза.


2.2 Молекулярная кристаллическая решетка.
В узлах решётки таких кристаллов лежат молекулы с неполярной ковалентной связью. При образовании этих молекул внешняя электронная оболочка каждого атома оказывается полностью заполненной за счёт «обобществления» пары валентных электронов. Так как спаренные электроны в равной степени принадлежат каждому атому, то центр положительного заряда атома совпадает с центром отрицательного заряда и поэтому молекула оказывается электрически нейтральной, незаряженной. В результате в отдельные моменты времени молекула представляет собой электрический диполь. Эти диполи взаимно притягивают друг друга. Эти кристаллы называют молекулярными кристаллами в силу того, что в них явно можно выделить молекулы вещества. В узлах молекулярной кристаллической решетки находятся молекулы. Молекулы удерживаются друг около друга слабыми межмолекулярными силами. Эти кристаллы непрочны, имеют запах.

Кристалл серы.
2.3 Ионная кристаллическая решетка.
Характерные черты этих кристаллов удобно рассмотреть на примере кристалла поваренной соли. Известно, что в молекуле NaCl единственный валентный электрон натрия большее время проводит около атома хлора. В результате образуются положительный ион натрия и отрицательный ион хлора, взаимодействующие между собой благодаря электрическим силам. Ион натрия и ион хлора имеют полностью заполненные электронные оболочки и симметричное электронное облако. Это значит, что при сближении частиц вещества каждый ион натрия будет взаимодействовать не с одним каким-либо ионом хлора, а попытается присоединить к себе возможно большее их число. Аналогично будет вести себя и ион хлора. В результате в кристалле поваренной соли каждый ион хлора окажется окружённым ионами натрия, а каждый ион натрия – ионами хлора. Ионная связь достаточно сильно скрепляет частицы вещества в кристалле, поэтому эти кристаллы отличаются прочностью. Молекулу NaCl из всего кристалла поваренной соли отделить невозможно. Весь кристалл, по существу, представляет собой одну гигантскую молекулу. Одиночные молекулы NaCl бывают лишь в газообразном состоянии. Твердые тугоплавкие вещества, без запаха, хорошо растворимые в воде.
2.4 Металлическая кристаллическая решетка.
Металлическая кристаллическая решетка образована положительными ионами металлов, между которыми осуществляется металлический тип связи. Металлическая связь обусловлена притяжением частично ионизованных атомов металлов и валентных электронов, образующих единое электронное облако. Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по кристаллу. Атом любого металла имеет незаполненную валентную электронную оболочку. В результате кристалл металла можно представить как ионную решётку, состоящую из атомов металла, лишённых валентных электронов, и электронного газа, «цементирующего» решётку из положительно заряженных ионов.
Кристалл золота.
