
- •Алканы (парафины) – это углеводороды, в которых все связи одинарные. Их называют насыщенными в отличие от углеводородов с кратными связями.
- •Июпак (iupac International of Pure and Applied Chemistry).
- •Химические свойства алканов.
- •Циклоалканы (циклопарафины)
- •Строение циклоалканов.
- •Конформации шестичленного цикла: а — кресло: 6 — ванна.
Алканы (парафины) – это углеводороды, в которых все связи одинарные. Их называют насыщенными в отличие от углеводородов с кратными связями.
Общая формула CnH2n+2 |
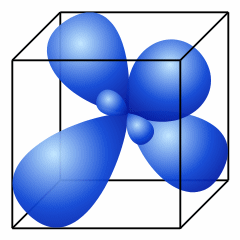
Все атомы углерода в алканах имеют sp3- гибридизацию.
|
Физические свойства: Первые четыре члена гомологического ряда С1 – С4 – бесцветные газы, C5–C17 – жидкости, начиная с C18 – твердые вещества. Все алканы легче воды, не растворимы в воде и не смешиваются с ней. С увеличением длины цепочки увеличиваются температуры кипения и плавления. У алканов с разветвленным углеродным скелетом температуры кипения и плавления ниже, чем у неразветвленных с таким же числом атомов углерода в молекуле. |
Типы атомов углерода
 вторичный
третичный
вторичный
третичный
С
│
С
 –С–С–С–С
первичный
–С–С–С–С
первичный
│ │
С С
четвертичный
Гомологический ряд – это совокупность органических соединений, отличающихся друг от друга по составу на одну или несколько СН2-групп (гомологическая разность).
Представители одного гомологического ряда называются гомологами.
Первые 10-ть членов ряда алканов:
Углеводороды-алканы |
|
формула |
название |
СН4 |
метан |
С2Н6 |
этан |
С3Н8 |
пропан |
С4Н10 |
бутан |
С5Н12 |
пентан |
С6Н14 |
гексан |
С7Н16 |
гептан |
С8Н18 |
октан |
С9Н20 |
Нонан |
С10Н22 |
декан |
Радикалы предельных углеводородов:
СН3—
метил
СН3-СН2—
этил
СН3—СН2—СН2 СН3—СН—СН3
пропил вторичный пропил (изопропил)
СН3—СН2—СН2 СН2— СН3—СН—СН2— СН3—СН2—СН СН3
Бутил
СН3
изобутил вторбутил
СН3—СН—СН3
СН3
Третбутил
СН3
СН3—СН—СН2—СН2—
СН3—С—СН2—
СН3
изопентил неопентил СН3
Международная заместительная номенклатура
Июпак (iupac International of Pure and Applied Chemistry).
По заместительной номенклатуре углеводороды изостроения рассматриваются как производные нормальных углеводородов, в цепи которых атомы водорода замещены простыми углеводородными радикалами, образующими боковые цепи. В формуле предельного углеводорода, который требуется назвать, выбирают основу, т.е. самую длинную (главную) цепь углеродных атомов. Затем эти атомы последовательно нумеруют, начиная с того конца главной цепи, к которому ближе боковое ответвление. В названии соединения цифрами указывают номера углеродных атомов, при которых находятся боковые радикалы, затем (через дефис) названия этих радикалов и, наконец, название нормального углеводорода, имеющего столько же углеродных атомов, сколько их содержится в самой длинной цепи, т.е. в основе данного углеводорода. Например, гексаны (1) и (2) по заместительной номенклатуре называют:
1 2 3 4 5 1 2 3 4 5
СН3—СН—СН2—СН2—СН3 СН3—СН2—СН—СН2—СН3
СН3 (1) СН3 (2)
2-метилпентан 3-метилпентан
Если в углеводороде несколько одинаковых боковых радикалов, в названии (через запятые) пишут номера всех углеродных атомов цепи, при которых одинаковые радикалы находятся, потом прописью, пользуясь греческими, указывают число этих радикалов, а затем уже их название. Так, гексаны (3) и (4) называют:
1 2 3 4 СН3
СН3—СН—СН—СН3 (3) 1 2 3 4
СН3—С—СН2—СН3 (4)
СН3 СН3
2,3-диметилбутан СН3 2,2-диметилбутан
Самую длинную углеродную цепь выбирают и нумеруют так, чтобы вне ее остались наиболее простые остатки, а цифры в названии, указывающие положение остатки, были бы наименьшими. Если на равных расстояниях от концов цепи имеется с одной стороны один, а с другой два таких же боковых остатка, нумерацию начинают со стороны двух остатков (со стороны наибольшего разветвления цепи). А если в равных положениях от концов цепи находятся различные по сложности боковые остатки, начало нумерации ведут со стороны простейшего.
В общем названии углеводорода вначале указывают положение, число и наименование простейших остатков, потом следующие по сложности, т.е. сначала метильных, затем этильных, пропильных, бутильных и т.п. Приведем для примера формулу и название одного из деканов (С10Н22) изостроения:
5 4 3
СН3—СН2—СН—СН2—СН3
2
CH3—C—CH3
1
2,2,-диметил-3-этилпентан СН3
Алгоритм составления названия алканов:
Выбрать самую длинную цепь (на первом этапе обучения целесообразно ее обводить).
Пронумеровать атомы углерода в этой цепи, начиная от ближайшего к разветвлению конца.
Обвести радикалы. Назвать их, начиная с простейшего, указав номер атома, у которого стоит этот радикал. Если радикал встречается несколько раз, использовать множительную приставку – ди-, три-, тетра- и т.д.
Общее название углеводорода дать по числу атомов углерода в цепи (корень названия ПУВ + суффикс АН).
Алгоритм построения структурной формулы по названию алкана:
В названии алкана выделяют корень. Обвести его значком корня.
Изобразить углеродный скелет в соответствии с наименованием корня.
Пронумеровать атомы углерода в углеродном скелете (с любой стороны).
Проставить символы радикалов у соответствующих атомов углерода.
Дополнить свободные валентности атомов углерода, символами атомов водорода, помня, что атом углерода в органических соединениях всегда четырех валентен.
Виды изомерии у алканов и галогеналканов.
1) Для алканов возможна только структурная изомерия углеродного скелета (начиная с С4)
2) Для галогеналканов, нитроалканов характерна также изомерия положения заместителей – галогенов, нитрогрупп (начиная с С3)
СН3-СН2-СН2-Сl 1-хлорпропан СН3-СН-СН3 2-хлорпропан
׀
Cl
Получение алканов:
1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов: 2CH3–CH2Br + 2Na CH3–CH2–CH2–CH3 +2NaBr Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов. А для получения несимметричных алканов используем смесь галоген производных,например: CH3 CH3 CH3—CH—J + 2Na + J—CH2—CH3 CH3—CH—CH2—CH3 + 2NaJ иодистый изопропил иодистый этил 2-метилбутан Однако нетрудно понять, что когда в реакцию вводят смесь двух галогенпроизводных, эта реакция будет протекать еще по двум направлениям, т.к. молекулы каждого из галогенпроизводных могут реагировать попарно друг с другом, а именно: CH3 CH3 CH3 CH3 CH3—CH—J + 2Na + J—CH—CH3 CH3—CH—CH—CH3 + 2NaJ иодистый пропил иодистый пропил 2,3-диметилбутан CH3—CH2—J + 2Na + J—CH2—CH3 CH3—CH2—CH2—CH3 + 2NaJ иодистый этил иодитый этил бутан
|
2) Декарбоксилирование солей карбоновых кислот (реакция Дюма): сплавление со щелочами солей карбоновых кислот. Так получают метан при нагревании ацетата натрия с гидроксидом натрия. CH3COONa + NaOH -t CH4 + Na2CO3
|
2CH3COONa + 2H2O –(эл.ток) 2СО2 + Н2 + С2Н6 + 2NaOH катод: идёт разрядка воды 2Н2О + 2е Н2 + 2ОН-
|
4) Метан также можно получить гидролизом карбида алюминия. Al4C3 + 12H2O 3CH4 + 4Al(OH)3
|
5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). R–CH=CH–R' + H2 -kat R–CH2–CH2–R'
|
6) Предельные углеводороды от C1 до C11 выделяют фракционной перегонкой нефти, природного газа или смесей углеводородов, получаемых гидрированием угля.
|
7) Гидрирование угля, оксида углерода в присутствии катализаторов (железо, кобальт, никель) при повышенной температуре: n C + (n+1) H2 –400С,p CnH2n+2 n CO + (2n+1) H2 –200С,Ni CnH2n+2+ n H2O |



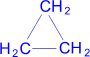 (циклопропан)
+ H2
-Pd CH3
–CH2
–CH3(пропан)
(циклопропан)
+ H2
-Pd CH3
–CH2
–CH3(пропан)