
- •Общие сведения о горении
- •1.1. Введение
- •1.2. Основные понятия
- •1.3. Горение и условия его протекания
- •1.4. Понятие о кинетическом и диффузионном горении
- •1.5. Химические реакции горения
- •1.6. Горение в атмосферном воздухе
- •1.7. Классификация и характеристика пожароопасных веществ [3]
- •Трудногорючие вещества
- •Негорючие вещества
- •1.8. Показатели пожаро- и взрывоопасности веществ и материалов
- •Особенности горения различных веществ
- •2.1. Горение газов
- •Влияние температуры смеси
- •Влияние давления смеси
- •Влажность воздуха
- •Содержание примесей, замедляющих реакции горения
- •Температура горения
- •2.2. Горение жидкостей
- •Криогенные вещества – вещества, у которых критическая температура ниже температуры окружающей среды. Хранение и транспортировка их – в криогенных сосудах.
- •2.3. Горение твердых веществ
- •Горение древесины
- •Горение полимерных материалов
- •Скорость горения органических веществ
- •2.4. Горение пылевоздушных смесей
- •Горючие пыли
- •Взрывоопасные
- •Пожароопасные
- •3. Общие сведения о взрыве
- •3.1. Взрыв и его разновидности
- •3.2. Классификация взрывных явлений
- •Классификация взрывов
- •Атомные группировки, сообщающие соединению взрывчатость
- •3.3. Характеристика аварийных взрывов
- •4. Общие сведения о взрывчатых веществах (вв)
- •4.1. Основные понятия
- •Формы взрывчатого превращения
- •4.2. Классификация взрывчатых веществ
- •4.3. Характеристика взрывчатых веществ
- •Температура вспышки и чувствительность к удару
- •Характеристика взрывчатых веществ
- •4.4. Химические реакции взрывных превращений
- •4.5. Объем продуктов взрывчатого разложения
- •4.6. Теплота и температура взрыва
- •4.7. Давление продуктов взрыва
Температура горения
Температура горения – Тгор. – температура, до которой нагреваются при горении продукты сгорания без учета потерь тепла (теоретическая температура горения) или с учетом потерь тепла (действительная температура горения).
Максимальную температуру горения можно вычислить по формуле
![]() ,
к,
,
к,
где Q – количество тепла, выделяющееся при горении, Дж; ΔQ – потери тепла, Дж; ΣСр – сумма теплоемкости продуктов сгорания, Дж/к.
Температуры горения некоторых газов в смесях с воздухом и кислородом достаточно высоки (до 30000С), что вызывает тепловое самоускорение реакции (т.е. происходит саморазогрев системы «горючее – окислитель»).
Скорость горения
Нормальная скорость горения – скорость перемещения фронта реакции относительно несгоревшего газа в направлении нормали к поверхности фронта пламени (см/с; м/с).
Массовая скорость горения смеси – количество вещества, воспламеняющееся на единице поверхности пламени в единицу времени (г/см2·с).
Нормальная скорость горения зависит от состава смеси, давления, начальной температуры и наличия примесей:
состав: по мере приближения к пределам ВКПВ и НКПВ скорость падает, но не равна нулю;
повышение давления может по-разному влиять на скорость, часто наблюдается понижение скорости;
повышение температуры увеличивает скорость (относительно слабо);
примеси: инертные уменьшают скорость горения; активные (например, вода сильно ускоряет реакцию окисления оксида углерода с кислородом, а при большом ее количестве – скорость горения падает).
Анализ аварий в химической, добывающей и многих других отраслях промышленности показывает, что взрывы газо- и паровоздушных смесей, занимают одно из ведущих мест. Для предаварийного состояния характерно образование взрывоопасных смесей горючих газов или паров горючих жидкостей с воздухом, при наличии источника зажигания горение таких смесей практически мгновенно переходит во взрывное. Это может происходить как в аппаратах и коммуникациях, так и в производственных зданиях и на территориях (Ашинская трагедия).
Пожаро- и взрывоопасноть газов зависит от их свойств. Наиболее пожаро-взрывоопасными являются газы, имеющие широкую область воспламенения, низкий НКПВ, небольшую энергию зажигания, большую нормальную скорость распространения пламени. К таким газам относятся, например, ацетилен, водород, сероводород и др.
2.2. Горение жидкостей
Жидкости – вещества в конденсированном агрегатном состоянии, промежуточном между твердым и газообразным. В жидкостях расстояние между молекулами – порядка размеров самих молекул, а силы межмолекулярного взаимодействия весьма значительны.
Процесс горения жидкостей начинается с воспламенения паро-воздушной смеси. Стационарный процесс горения устанавливается только при определенной температуре жидкости, однако, и при более низких температурах жидкости уже могут представлять пожарную опасность, т.к. над поверхностью их может создаться взрывоопасная концентрация паров.
Горение жидкостей характеризуется двумя взаимосвязанными процессами – испарением и собственно сгоранием паро-воздушной смеси над поверхностью жидкости. Зоной горения является тонкий светящийся слой газов, в который с поверхности жидкости поступают горючие пары, а из воздуха диффундирует кислород. Образующаяся стехнометрическая смесь сгорает мгновенно. Испарению принадлежит исключительно важная роль, поскольку в конечном итоге оно определяет скорость сгорания жидкости.
Таким образом, все горючие жидкости способны испаряться и горение их происходит в паровой фазе. Количество пара зависит от состава и температуры жидкости. Процесс горения паров определяется областью воспламенения (интервал между НКПВ и ВКПВ), энергией источника зажигания, температурой горения и скоростью распространения пламени (по аналогии с горением газов).
Важнейшей характеристикой жидкости, определяющей процесс горения, является температура кипения.
У химически однородных веществ (индивидуальных соединений, в частности, углеводородов) температура кипения остается постоянной, у сложных смесей (например, моторных топлив) она изменяется, повышаясь по мере выкипания более легколетучих компонентов.
Температура кипения индивидуальных углеводородов при атмосферном давлении определяется по формуле
![]() ,
,
где М – молекулярная масса вещества.
Как правило, НКПВ для паров горючих жидкостей ниже, чем для большинства горючих газов, поэтому пары жидкости более пожаро- и взрывоопасны. Область воспламенения горючих жидкостей, как правило, уже, чем у горючих газов.
Температура вспышки – наименьшая температура жидкости, при которой ее пары воспламеняются от источника зажигания без последующего устойчивого горения. При температуре вспышки жидкость становиться опасной в пожарном отношении.
Температурными пределами воспламенения паров в воздухе называются такие температуры вещества, при которых концентрация его паров в воздухе равны соответственно НКПВ и ВКПВ.
Температурные пределы воспламенения применяют при расчетах безопасных температурных режимов работы закрытых технологических аппаратов с жидкостями.
Важнейшие характеристики некоторых горючих жидкостей и температурные пределы воспламеняемости приведены в табл. 2.5 и 2.6 конспекта лекций [4].
Сжиженные горючие газы (СГГ)
СГГ широко применяют в качестве технологического сырья и топлива. Существует два основных способа хранения газов:
при постоянном давлении и изменяемом объеме;
при переменном давлении и постоянном объеме.
Для каждого конкретного сжиженного газа существуют оптимальные условия хранения – температура и давление в емкости.
Состояние вещества, при котором исчезает различие между его жидкой и газообразной фазами, называется критическим. Оно возникает при определенном давлении и температуре, называемых критическими:
критическая температура – температура, выше которой вещество не может находится в жидком состоянии;
критическое давление – давление, при котором еще сохраняется возможность сжижения газообразной фазы.
Объем, который занимает вещество в критическом состоянии, называется критическим.
Критические параметры вещества связаны следующим соотношением:
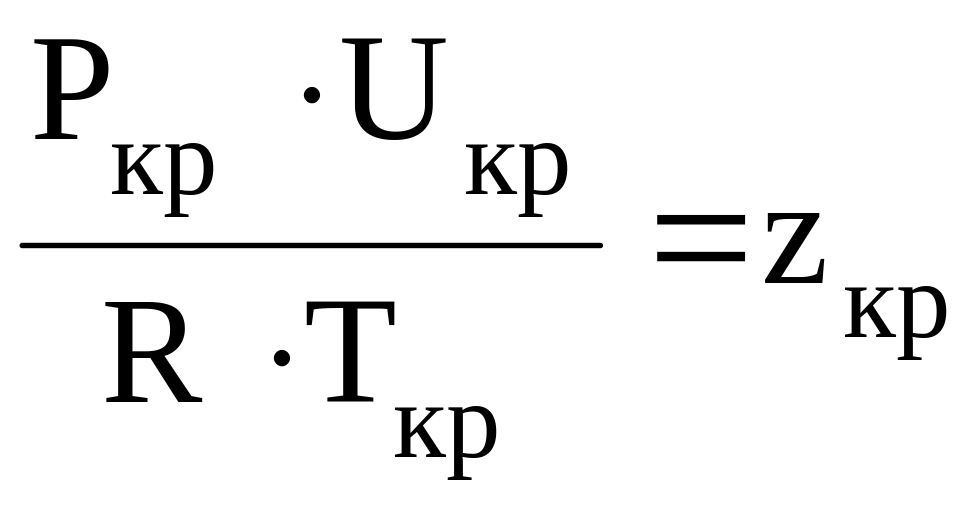 ,
,
где R = 8,314 Дж/(моль·к) – универсальная газовая постоянная; zкр – константа, равная 0,375 (для газов), 0,27 (для паров углеводородов тяжелее пропана).
