
13.4. Физико-химическое выделение компонентов при участии жидкой фазы
Многие процессы утилизации твердых отходов в промышленности основаны на использовании методов выщелачивания (экстрагирования), растворения и кристаллизации перерабатываемых материалов.
Выщелачивание (экстрагирование). Этот метод широко используется в практике переработки отвалов горнодобывающей промышленности, некоторых металлургических и топливных шлаков, пиритных огарков, древесных и многих других BMP. Метод основан на извлечении одного или нескольких компонентов из комплексного твердого материала путем его (их) избирательного растворения в жидкости-экстрагенте.
В зависимости от характера физико-химических процессов, протекающих при выщелачивании, различают простое растворение (целевой компонент извлекается в раствор в составе присутствующего в исходном материале соединения) и выщелачивание с химической реакцией (целевой компонент, находящийся в исходном материале в составе малорастворимого соединения, переходит в хорошо растворимую форму).
Минимальный расход реагентов, необходимый для полного извлечения в раствор целевого компонента, и возможность осуществления процесса определяются величиной концентрационной константы равновесия реакции Кс. Например, для случая выщелачивания
![]()
концентрационная константа равновесия Кс выражается следующим образом:
Кс=[C2B]равн/[CD]2равн (III.75)
При достижении равновесия в растворе остается неизрасходованный реагент CD:
![]()
Таким образом, необходимый избыток реагента CD на 1 моль выщелачиваемого компонента АВ должен быть равен:
![]()
а общий
расход реагента CD
должен составлять
![]() .
.
Константа равновесия реакции Кр , например реакции аА + bВ dD + gG. может быть выражена различными способами: через активности а1 ;, коэффициенты активности γi и концентрации [i] компонентов в условиях равновесия:
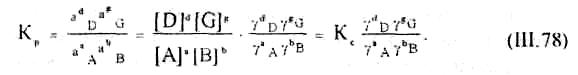
Значения констант равновесия находят в справочной литературе, рассчитывают по известным величинам термодинамических функций участвующих в реакции веществ, либо по отношению произведений растворимости содержащего целевой компонент исходного соединения и твердого продукта реакции, сопровождающейся образованием малорастворимого продукта, или по данным о значениях электрохимических потенциалов при протекании окислительно-восстановительной реакции, а также определяют экспериментально.
Скорость выщелачивания обычно изменяется в ходе процесса и зависит от концентрации реагентов, температуры, интенсивности перемешивания, величины поверхности твердой фазы и других факторов. Поэтому в общем виде она может быть представлена выражением:
dG/dτ = -jS. (III.79)
где G - количество выщелачиваемого вещества в твердой фазе; j -количество выщелачиваемого вещества, переходящее в раствор в единицу времени τ с единицы поверхности твердой фазы (поток выщелачивания, удельная скорость выщелачивания); S - поверхность взаимодействия фаз.
При наиболее полной модели взаимодействия твердое - жидкость, соответствующей растворению с обменной реакцией, которая протекает с образованием новой твердой фазы:
![]()
процесс включает диффузию реагента к поверхности твердой фазы через пограничный слой жидкости, диффузию реагента через слой твердого продукта реакции или выщелоченный слой инертного материала, химическую реакцию на поверхности выщелачиваемого вещества, диффузию растворенного вещества от реакционной поверхности через твердый слой и пограничный слой жидкости. Соответствующее этим условиям выражение для потока выщелачивания j получено в виде:
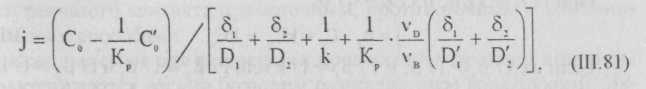
где δ1 и δ2 - величины соответственно пограничного слоя жидкости и твердого продукта реакции; D1; D2, D1', D2' - коэффициенты диффузии соответственно реагента в растворе и слое продукта реакции и растворенного продукта в этих слоях; k, Кр - константы соответственно скорости в равновесия прямой реакции; Со, Со' - концентрации соответственно реагента и продукта в растворе; νВ , νD - число молей соответственно реагента и продукта по вышеуказанной реакции.
Выражение (III.81) значительно упрощается, если реакция практически необратима (т. е. 1/Кр ≈ 0):
![]()
Величину Di /δi = βi называют коэффициентом массопередачи, а обратную величину 1 / βi = δi/Di - диффузионным сопротивлением. Величину 1/k называют химическим сопротивлением. Таким образом, сумма диффузионных и химического сопротивлений представляет общее сопротивление процессу:
l/β1 + l/β2+ l/k = l/β∑, (III.83)
откуда общий коэффициент массопередачи
![]()
и с учетом (III.82)
j=β∑C0 , (III.85)
При установившемся режиме для потока выщелачивания и его отдельных стадий справедливо равенство:
j=β∑C0=β1(C0-C1)=β2(C1-C2) = kC2 (III.86)
где С1 и С2 - концентрации реагента соответственно на границе раствор - инертная твердая фаза и на поверхности ядра выщелачиваемого материала.
При β1≈β2≈k уменьшение концентрации реагента на каждой стадии примерно одинаково: Со - С1 ≈ С1 - С2 ≈ С2 (для необратимой химической реакции, когда С2 падает до нуля).
При 1/k >>1/β1 и1/k >> 1/β2
j≈β∑*С0 = kС2 ≈ kС0. (III.87)
Если же 1/β1 >> 1/β2 и 1/β1 >> 1/k или 1/β2 >> 1/β1 и 1/β2 >> 1/k, то соответственно
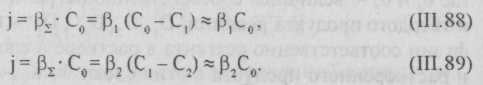
Таким образом, при значительном преобладании одного из сопротивлений общий поток выщелачивания может быть рассчитан как произведение наименьшего коэффициента массопередачи (или константы скорости реакции) на Со.
При образовании в процессе выщелачивания плотной оболочки твердого продукта наибольшую величину обычно имеет сопротивление 1 / β2 и процесс, лимитируемый диффузией через этот слой, протекает во внутренней диффузионной области. Если такая оболочка не образуется (1 / β2 = 0) и величина к достаточно велика, процесс может происходить во внешней диффузионной области при лимитировании его скорости диффузией через слой раствора. В случае же лимитирования процесса скоростью химической реакции он протекает в кинетической области.
При выборе экстрагента (растворителя) к нему предъявляют ряд требований в отношении селективности, величины коэффициентов распределения и диффузии, плотности, горючести, коррозионной активности, токсичности и ряда других показателей. На процесс выщелачивания обычно существенное влияние оказывают такие параметры как концентрация экстрагента, размер и пористость зерен обрабатываемого материала, интенсивность гидродинамики, температура, наложение различных силовых полей (ультразвуковых, постоянных электрических, электромагнитных, высокочастотных, центробежных и других) и в некоторых случаях присутствие различных микроорганизмов (бактериальное выщелачивание).
Процессы экстракции могут быть периодическими и непрерывными. Периодические процессы проводят настаиванием (обработкой залитого экстрагентом материала в течение определенного времени с последующим сливом экстрагента и заменой его свежим) или вытеснением - перколяцией (образующийся экстракт непрерывно вытесняется из слоя материала чистым растворителем). Более прогрессивное непрерывное экстрагирование проводят путем многоступенчатого контакта прямоточным, противоточным и комбинированным способами.
Используемые для реализации процессов экстракции аппараты характеризуются весьма большим разнообразием конструкций. Экстракторы классифицируют по способу действия (периодические и непрерывно-действующие), по направлению движения растворителя и твердой фазы (противо- и прямоточные, с процессом полного смешения, с процессом в слое и комбинированные), по характеру циркуляции растворителя (с однократным прохождением, с рециркуляцией и оросительные) и по ряду других принципов.
При расчете производительности реактора выщелачивания любого типа основываются на заданной степени извлечения или остаточном содержании целевого компонента в обрабатываемом твердом материале С , определяя необходимое время выщелачивания τ0 по кинетической кривой Сост = f (τ).
При этом производительность аппарата по пульпе для заданных условий выщелачивания определяют по формуле:
Q = V/(τ0 + ∆τ), (III. 90)
где V - полезная емкость реактора; ∆τ - суммарное время загрузки, выхода на режим и выгрузки реактора.
Максимальная производительность непрерывнодействующего реактора выщелачивания полного смешения при непрерывном распределении частиц по времени пребывания и небольших величинах Q / V и τ0 может быть определена с использованием выражения:

Оценка производительности периодически- и непрерывнодействующего реакторов, проводимая соответственно по выражениям (III.90) и (III.91) при равных значениях V и τ0, позволяет заключить, что в первом случае она гораздо выше. Увеличения производительности единичных непрерывнодействующих реакторов достигают, объединяя их в прямоточный каскад, что обеспечивает снижение выхода твердых частиц с малым временем пребывания. Принципиальные технологические схемы процессов прямоточного и противоточного ступенчатого экстрагирования представлены на рис. III-10. Более рациональная с позиций кинетики организация противоточного каскада требует разделения твердой и жидкой фаз после каждого аппарата выщелачивания.
Растворение. Этот метод заключается в реализации гетерогенного взаимодействия между жидкостью и твердым веществом, сопровождаемого переходом последнего в раствор, и широко используется в практике переработки многих твердых отходов.
Возможность самопроизвольного растворения твердого вещества может быть оценена знаком величины AG (изменения энергии Гиббса), определяемой соотношением:
![]()
где ∆Н - изменение энтальпии; ∆S - изменение энтропии; Т - абсолютная температура.
При ∆G < 0 возможно растворение, ∆G = 0 соответствует равновесию в системе, при ∆G > 0 вероятен процесс кристаллизации. Растворимость твердых веществ в жидкостях обычно ограничена концентрацией насыщения Cs.
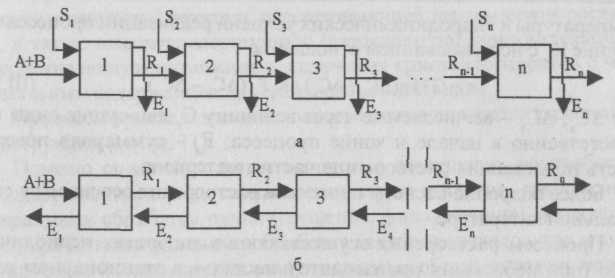
Рис. Ill-10. Схемы прямоточного (а) и противоточного (б) ступенчатого экстрагирования: 1,2,3,..., п - ступени; А + В -твердый материал; S, S1, S2, S3, ..., Sn -потоки растворителя; R1, R2, R3 .... Rn - потоки рафината; Е1, E2, Е3, …, Еn - потоки экстракта
Скорость растворения как массообменного процесса может быть выражена уравнением:
dG/dτ=KмF(Cs-Cτ), (III.93)
где G - количество растворенного вещества, кг; Км - коэффициент массопередачи (константа скорости процесса); F - общая поверхность растворяемых частиц в момент времени τ, м2; Cτ - концентрация раствора в момент времени τ, кг/м3.
В практике встречаются случаи, когда скорость растворения лимитируется не диффузией растворенного вещества от поверхности твердой фазы в раствор, а скоростью межфазного перехода вещества в раствор (например, для солей K2SO4 * 2MgSO4, MgSO3 • Н2О). Для веществ, растворение которых не осложняется этой скоростью (диффузионнорастворяющихся веществ, к числу которых принадлежит большинство солей), величина Км может быть определена по формуле:
Км=К∆ρ1/ 3μ-3ж(Dμж)2/3, (III.94)
где К - коэффициент массоотдачи (для диффузионнорастворяющихся солей К = 70±10); ∆ρ - разность плотностей твердой и жидкой фаз; μж - динамическая вязкость жидкости; Dμж- эффективный (при μж = 1) коэффициент диффузии растворенного вещества.
Время т, необходимое для полного растворения данного количества G вещества, может быть оценено при известной для данной температуры и гидродинамических условий реализации процесса величине Км с использованием отношения:
τ=G31n(∆Cн/∆Cк)/KмFн(∆Cн-∆Cк), (III. 95)
где ∆Сн, ∆Ск - вычисляемые через величину Cs движущие силы соответственно в начале и конце процесса; Fh - суммарная поверхность подлежащих растворению частиц материала.
Более подробно расчеты процессов растворения освещены в специальной литературе.
Процессы растворения осуществляют в аппаратах периодического (при небольших производительностях - в стационарном слое твердых частиц или с перемешиванием) и непрерывного (во взвешенном слое или с перемешиванием) действия разнообразных конструкций. Для интенсификации растворения в ряде случаев используют различные способы наложения полей колебаний.
Кристаллизация. Выделение твердой фазы в виде кристаллов из насыщенных растворов, расплавов или паров имеет большое распространение при переработке различных твердых отходов.
Для оценки поведения растворов при их кристаллизации и рационального выбора способа проведения этого процесса используют диаграммы состояния растворов, выражающие зависимость растворимости соответствующих солей от температуры. Скорость процесса кристаллизации зависит от многих факторов (степени пересыщения раствора, температуры, интенсивности перемешивания, содержания примесей и др.) и изменяется во времени, проходя через максимум. Соотношение скоростей основных параллельных процессов возникновения зародышей кристаллов и их роста определяет величину суммарной поверхности зерен образующейся твердый фазы.
Создание необходимого для кристаллизации пересыщения раствора обеспечивают двумя основными приемами - охлаждением горячих насыщенных растворов (изогидрическая кристаллизация) и удалением части растворителя путем выпаривания (изотермическая кристаллизация) или их комбинацией (вакуум-кристаллизация, фракционированная кристаллизация, кристаллизация с испарением растворителя в токе воздуха или другого газа-носителя). Наряду с ними в практике кристаллизации из растворов иногда используют кристаллизацию высаливанием (введение в раствор веществ, понижающих растворимость соли), вымораживанием (охлаждением растворов до отрицательных температур с выделением кристаллов соли или их концентрирование удалением части растворителя в виде льда) или за счет химической реакции, обеспечивающей пересыщение раствора, а также высокотемпературную (автоклавную) кристаллизацию, обеспечивающую возможность получения кристаллогидратов с минимальным содержанием кристаллизационной влаги.
Процессы кристаллизации осуществляют в аппаратах различной конструкции (см. гл. 11).
Помимо описанных выше методов, в технологии переработки твердых отходов в ряде случаев используют и другие, связанные с операциями обработки пульп (сгущение, фильтрование), а также со специфическими приемами обработки как самих отходов, так и синтезируемых из них материалов (уплотнение, обеспыливание, остекловывание, вальцевание, опудривание, каландрование и др.).
