
- •Аннотация
- •1. Введение
- •1.1 Общие правила выполнения лабораторных работ.
- •1.2. Лабораторное оборудование.
- •1.3 Вычисления.
- •1.4 Количество и концентрация вещества.
- •Общие указания по выполнению лабораторных работ.
- •Работа 1. Ознакомление с некоторыми операциями лабораторной практики и измерительными приборами.
- •Работа 2. Классы неорганических соединений.
- •Работа 3. Определение молярной массы диоксида углерода.
- •Работа 4. Электронная структура атомов и одноатомных ионов.
- •Работа 5. Кинетика химических реакций.
- •Работа 6. Химическое и адсорбционное равновесие.
- •Работа 7. Концентрация растворов.
- •Работа 8. Свойство водных растворов электролитов.
- •Работа 9.Гидролиз солей.
- •Работа 10. Окислительно-восстановительные реакции.
- •Работа 11. Основы электрохимии.
- •Работа 12. Электролиз.
- •Работа 13. Общие химические свойства металлов.
- •Работа 14. Свойства d-элементов 4-го периода.
- •Работа 15. Свойства элементов, применяемых в полупроводниковой технике.
- •Работа 16. Определение жесткости и умягчение воды.
- •Работ 17 Органические соединения.
- •Работа. 18. Свойства элементов подгруппыViв иViiв
- •Работа 19. Свойства элементов подгруппыViiib.
- •Работа 20. Свойства элементов подгруппыIva.
- •Работа 21, Свойства элементовVAиVia.
Работа 4. Электронная структура атомов и одноатомных ионов.
Цель работы: привить навыки составления формул, выражающих электронную конфигурацию атомов и одноатомных ионов металлических и неметаллических элементов.
Согласно
квантово - механическим представлениям
состояния каждого электрона в атоме
химического элемента определяется
значениями четырех квантовых чисел
![]() ,
,![]() ,
,![]() ,
,![]() .
.
Главное
квантовое число
![]() принимает значения ряда целых чисел и
характеризует уровень энергии электрона
в атоме. Если
принимает значения ряда целых чисел и
характеризует уровень энергии электрона
в атоме. Если![]() ,
то уровень электрона минимальный.
,
то уровень электрона минимальный.
Орбитальное
квантовое число
![]() принимает значения в пределах от 0 до
принимает значения в пределах от 0 до![]() и характеризует подуровень электрона
на данном энергетическом уровне. Для
обозначения энергетических подуровней
используются строчные буквы латинского
алфавита:
и характеризует подуровень электрона
на данном энергетическом уровне. Для
обозначения энергетических подуровней
используются строчные буквы латинского
алфавита:
![]()
Используя цифровые значения n и буквенные обозначения можно составить формулу, отражающую электронную конфигурацию химического элемента.
Максимальное
число электронов в атоме, имеющих
одинаковый уровень энергии определяется
как
![]() .
Максимальное число электронов, имеющих
одинаковый подуровень энергии на данном
энергетическом уровне определяется
как
.
Максимальное число электронов, имеющих
одинаковый подуровень энергии на данном
энергетическом уровне определяется
как![]() .
.
Каждый
энергетический подуровень делится на
квантовые ячейки, количество которых
связано с магнитным квантовым числом
![]() ,
принимающим значения от -1 до +1, включая
ноль.
,
принимающим значения от -1 до +1, включая
ноль.
Например,
на энергетическом подуровне Р электроны
могут быть трех состояниях (в трех
квантовых ячейках) так как при
![]()
![]() .
.
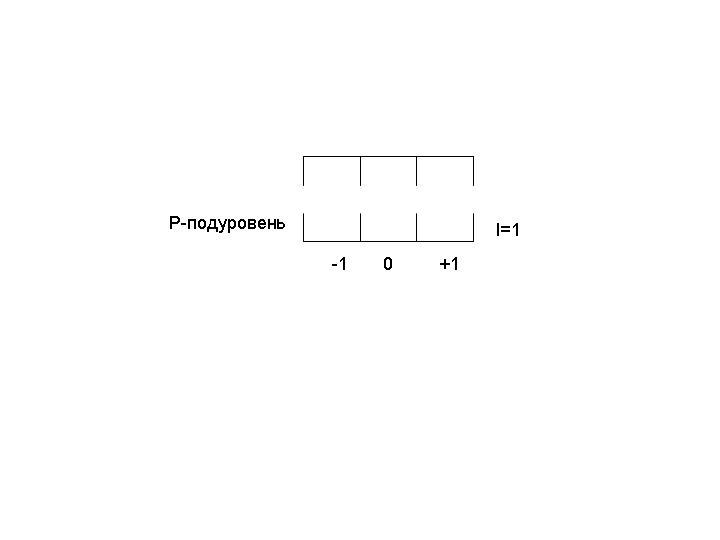
Квантовая
ячейка - графическое изображение атомной
орбитали, т.е. состояния электронов в
атоме, характеризующегося определенными
значениями трех квантовых чисел
![]() ,
,![]() ,
,![]() .
.
В
каждой квантовой ячейке может быть не
более двух электронов, отличающихся
друг от друга значением спинового
квантового числа (![]() и
и![]() ).
Электроны в квантовых ячейках принято
обозначать стрелками:
).
Электроны в квантовых ячейках принято
обозначать стрелками:![]() и
и![]() .
.
Общее число электронов в атоме определяется порядковым, номером химического элемента в периодической системе Д. И. Менделеева.
Элементы, со сходной электронной конфигурацией атомов называют электронными аналогами. Так, например, электронными аналогами являются азот и фосфор;
![]()
Электронные аналоги располагаются в периодической системе Д. И. Менделеева в одной подгруппе.
Экспериментальная часть.
ОПЫТ 1. Электронная структура атомов и одноатомных ионов металлов.
При окислении атомов металла число электронов в электронной оболочке уменьшается, и образуются ионы с положительным зарядом, например:
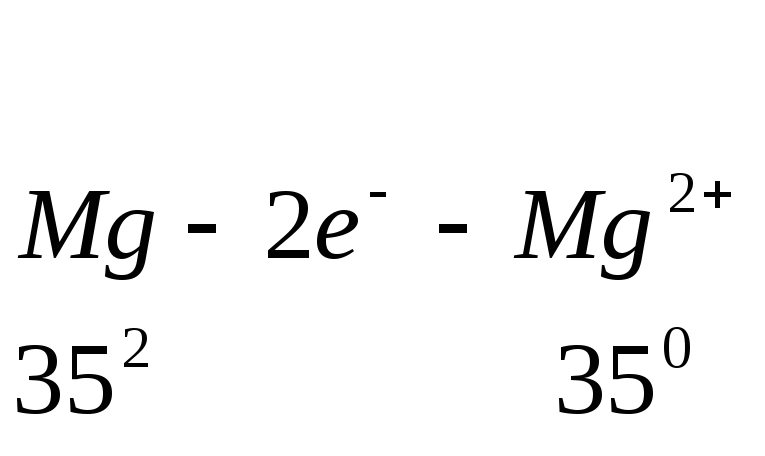
В
три пробирки (на 1/3 объема) налейте
раствор нитрата свинца
![]() .
В первую пробирку опустите железо, во
вторую-цинк, в третью-магний. Через
несколько минут осмотрите поверхность
металлов опущенных в раствор соли
свинца.
.
В первую пробирку опустите железо, во
вторую-цинк, в третью-магний. Через
несколько минут осмотрите поверхность
металлов опущенных в раствор соли
свинца.
Составьте уравнения реакций, которые прошли между железом, магнием и цинком с нитратом свинца. Опишите свои наблюдения. Заполните таблицу по образцу:
|
До реакции |
После реакции | ||
|
Химический знак атома или иона металла |
Электронная формула атома или иона |
Химический знак атома или иона металла |
Электронная формула атома или иона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приведите схему распределения в квантовых ячейках электронов, отвечающих сокращенным электронным формулам атомов: а) магния; б) железа; в) цинка; г) свинца.
Какими значениями квантовых чисел (n, I, m) характеризуется атомная орбиталь валентного электрона в атомах: а) магния; б) железа; в) цинка; г) свинца?
Найдите в периодической системе электронные аналоги свинца и запишите сокращенные формулы, выражающие электронную структуру атомов этих элементов.
ОПЫТ 2 Электронная структура атомов и одноатомных ионов металлов.
При восстановлении атомов металлов число электронов в электронной оболочке возрастает, и образуются ионы с отрицательным зарядом. Например;
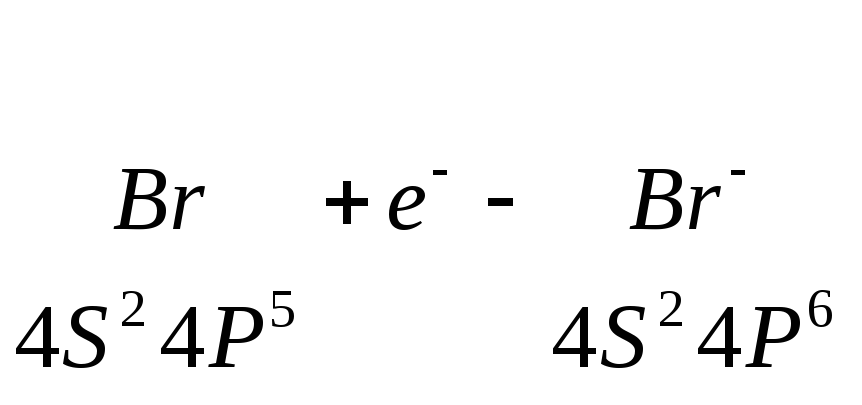
Опыт проводите под тягой. В две пробирки (на 1/3 объема) налейте растворы сульфида и иодида натрия. Опустите сначала в первую, а затем во вторую пробирку газоотводную трубку от аппарата Киппа и пропустите медленный ток хлора через раствор соли.
Составьте уравнения реакций и опишите свои наблюдения.
|
До реакции |
После реакции | ||
|
Химический знак атома или иона металла |
Электронная формула атома или иона |
Химический знак атома или иона металла |
Электронная формула атома или иона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приведите схему распределения в квантовых ячейках электронов, отвечающих сокращенным формулам атомов: а) серы; б) хлора; в) иода.
Какими
значениями квантовых чисел (![]() ,
,![]() ,
,![]() )
характеризуется атомная орбиталь
валентного электрона в атомах: а) серы;
б) хлора; в) иода?
)
характеризуется атомная орбиталь
валентного электрона в атомах: а) серы;
б) хлора; в) иода?
Найдите
в периодической системе Менделеева
элемент, электронная формула которого
![]() .
Какими значениями квантовых чисел
(главного и орбитального) характеризуются
внешние р - электроны в атоме этого
элемента?
.
Какими значениями квантовых чисел
(главного и орбитального) характеризуются
внешние р - электроны в атоме этого
элемента?
Контрольные вопросы.
Укажите значение главного квантового числа
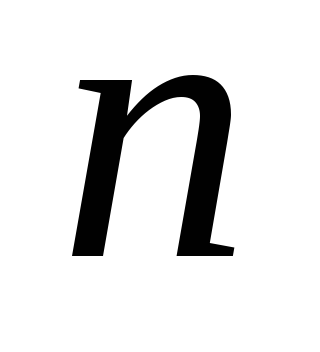 ,
характеризующее уровень энергии
электронов в атоме гелия.
,
характеризующее уровень энергии
электронов в атоме гелия.Укажите значение спинового квантового числа двух электронов внешнего энергетического уровня в атоме магния.
Какие значения магнитного квантового числа
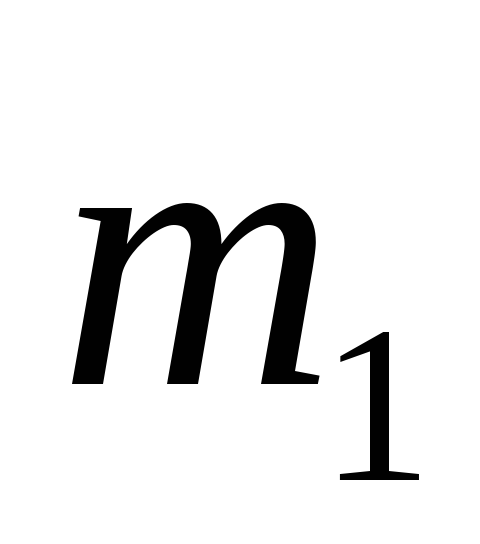 характеризую состояние р - электронов
в атоме азота.
характеризую состояние р - электронов
в атоме азота.Атому, какого химического элемента отвечает электронная конфигурация
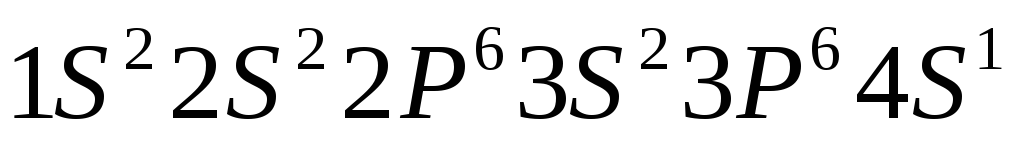 ?
?Электронную конфигурацию атома выражают следующей сокращенной формулой:
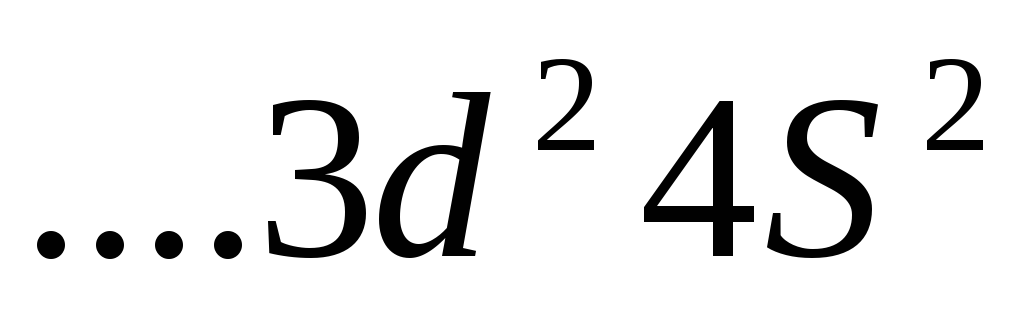 .
Что это за элемент?
.
Что это за элемент?Напишите формулу (полную и сокращенную) электронной конфигурации атома
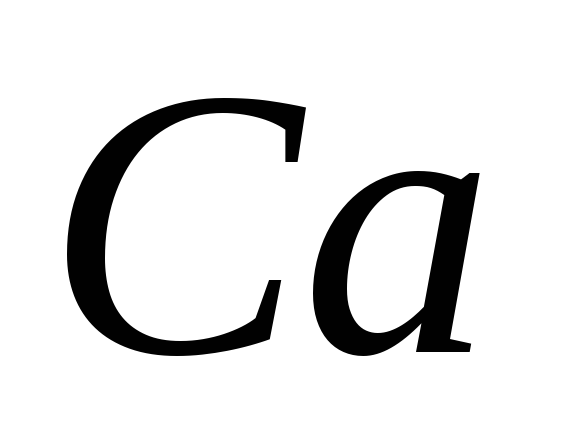 и иона
и иона .
.Сколько электронов на внешнем энергетическом уровне в атоме кремния? Покажите их расположение в квантовых ячейках.
Приведите схему распределения внешних электронов по квантовым ячейкам атома селена.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ.
