
- •Физическая химия. Спец. 320700. Тест № 2
- •Физическая химия. Спец. 320700. Тест № 3
- •Физическая химия. Спец. 320700. Тест № 4
- •Физическая химия. Спец. 320700. Тест № 5
- •Физическая химия. Спец. 320700. Тест № 6
- •Физическая химия. Спец. 320700. Тест № 7
- •Физическая химия. Спец. 320700. Тест № 8
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 10
- •Физическая химия. Спец. 320700. Тест № 11
- •Физическая химия. Спец. 320700. Тест № 12
- •Физическая химия. Спец. 320700. Тест № 13
- •Физическая химия. Спец. 320700. Тест № 14
- •Физическая химия. Спец. 320700. Тест № 15
- •Физическая химия. Спец. 320700. Тест № 16
- •Физическая химия. Спец. 320700. Тест № 17
- •Физическая химия. Спец. 320700. Тест № 18
- •Физическая химия. Спец. 320700. Тест № 19
Физическая химия. Спец. 320700. Тест № 7
1. Работа изотермического обратимого расширения идеального газа:
1) А = 0 2) А = p(V2-V1) 3) А = nCV(T1-T2) 4) А = nRT ln(V2/V1)
5) А = Q - U
2. Стандартная энтальпия Н298 сложного вещества – это:
1) абсолютная энтальпия его 1 моль при 25С и 1 атм
2) абсолютная энтальпия его 1 моль при 0С и 1 атм
3) абсолютная энтальпия его 1 г при 25С и 1 атм
4) относительная энтальпия его 1 г при 0С и 1 атм
5) относительная энтальпия его 1 моль при 25С и 1 атм
3. Если стандартная энтальпия образования жидкой воды равна 258 кДж/моль, то энтальпия её разложения составляет:
1) + 516 кДж/моль 2) - 129 кДж/моль 3) - 516 кДж/моль 4) – 258 кДж/моль
5) + 258 кДж/моль
4. Изменение энтропии вещества при изотермическом расширении идеального газа:
1) 2) 3)
4) 5)
5. Уравнение изотермы химической реакции с участием реальных газов при постоянстве давления и температуры:
1)
=
2)
=
3)
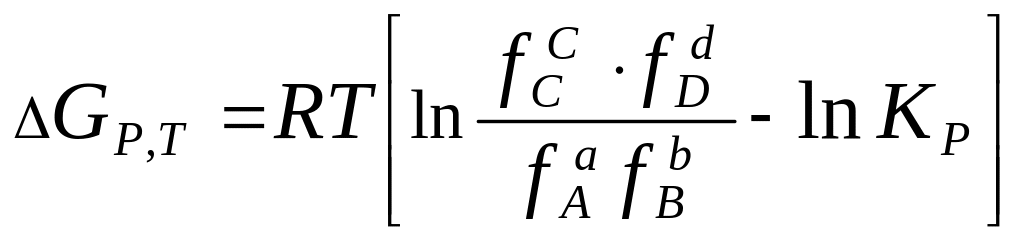
4) 5)
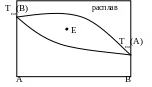
6. Для точки E на диаграмме справедливо:
Одна жидкая фаза; число степеней свободы: с = 2
Две фазы – жидкая и твердая; с = 1
Две фазы – жидкая и твердая; с = 2
Три фазы; число степеней свободы: с = 0
Одна твердая фаза ; число степеней свободы: с = 2
7. Закон разбавления Оствальда:
![]()

1) 2) Р = iСRT 3) 4)Tкип = iЕm 5) i = i + RTlnсi
8. Химическим условием фазового равновесия является:
1) ТiI = ТiII = ... = ТiФ 2) НiI = НiII = ... = НiФ
3) РiI = РiII = ... = РiФ 4) iI = iII = ... = iФ 5) ViI = ViII = ... = ViФ
9. Большей положительной энергии активации Eакт отвечает
1) меньшая константа скорости; 2)большая константа скорости
3) большая скорость реакции 4) больший выход продукта
5) меньший выход продукта
10. Цепной химической реакцией является:
1) процесс, протекающий через ряд регулярно повторяющихся элементарных реакций с участием радикалов, атомов или ионов;
2) быстро протекающая химическая реакция;
3) реакция, протекающая по замкнутому циклу;
4) процесс, состоящий из нескольких элементарных стадий с разными энергиями активации;
5) процесс, представляющий несколько параллельно протекающих реакций.
Физическая химия. Спец. 320700. Тест № 8
1. Работа адиабатического обратимого расширения идеального газа:
1) А = 0 2) А = p(V2-V1) 3) А = nRT ln(V2/V1) 4) А = nRT ln(V2/V1)
5) А = Q - U
2. Первый закон термодинамики для изотермического процесса имеет вид:
1) A = - U 2) Qp = – Н 3) dU = Q - A 4) Н = U + pV 5) QТ = A
3. Изменение энтропии вещества при плавлении, испарении или возгонке:
1) 2) 3)
4) 5)
4. Фундаментальное уравнение термодинамики, выраженное через естественные переменные Р и Т:
1) dH = TdS + Vdp 2) dU = TdS – pdV 3) dF = - pdV – SdT 4) dH = dU + pdV
5) dG = Vdp - SdT
5. Если все участники химической реакции: А + 3В = С являются газами, то соотношение между КС и КР равно:
1) КР = КС(RT)-3 2) КР = КС(RT)+3 3) КР = КС(RT)+2 4) КР = КС(RT)-2
5) КР = КСRT.
расплав
6. Для точки E на диаграмме справедливо:
1) Одна жидкая фаза; число степеней свободы: с = 2
2) Две фазы – жидкая и твердая; с = 1
3) Три фазы; число степеней свободы: с = 0
4) Одна твердая фаза ; число степеней свободы: с = 2
5) Одна твердая фаза ; число степеней свободы: с = 1
А
![]()
7. Молярная электропроводность по уравнениям: (1) ,
![]()
![]()
(2) , (3) справедлива для следующих растворов:
1) (1) – сильных электролитов; (2) – слабых электролитов;
(3) – предельно разбавленных слабых электролитов.
2) (1) – сильных электролитов; (2) – слабых электролитов;
(3) – предельно разбавленных сильных электролитов.
3) (1) – неэлектролитов; (2) – слабых электролитов;
(3) – предельно разбавленных сильных электролитов.
4) (1) – слабых электролитов; (2) – неэлектролитов;
(3) – предельно разбавленных сильных электролитов.
5) 1) – слабых электролитов; (2) – сильных электролитов;
(3) – предельно разбавленных сильных и слабых электролитов.
8. Термическим условием фазового равновесия является:
1) ТiI = ТiII = ... = ТiФ 2) НiI = НiII = ... = НiФ
3) РiI = РiII = ... = РiФ 4) iI = iII = ... = iФ 5) ViI = ViII = ... = ViФ
9. Периодом полураспада t1/2 химической реакции является:
1) время, в течение которого первоначальная скорость реакции уменьшается в два раза;
2) время, в течение которого реагирует половина взятого количества вещества;
3) время достижения состояния химического равновесия;
4) время, в течение которого первоначальная константа скорости реакции уменьшается в два раза;
5) время, в течение которого выделяется половина расчетной для данной реакции теплоты.
10. Основное уравнение теории активированного комплекса имеет вид:
![]()
![]()
1) 2) 3) 4) k = Т1/2exp(Eакт/RT)
5) kt =ln a/(a-x)
