
- •6.Потенциальная энергия, законы сохран мех энерг.
- •15.Термодинамичемкое равновесие.
- •19.Барометрическая Формула.
- •20. Распределения Максвелла.
- •Количество теплоты, полученное системой, в общем случае идёт на изменение внутренней энергии системы и на совершение системой работы.
- •26.Термодинамическая вероятность.
- •29.Стационарное движение жидкости, ур-ние Бернули.
- •30. Вязкость жидкости.
15.Термодинамичемкое равновесие.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объем, энтропия) в условиях изолированности от окружающей среды. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы(или движущие силы), изменения количества присутствующих фаз. Отличают тепловое, механическое, радиационное(лучистое) и химическое равновесия. На практике условие изолированности означает, что процессы установления равновесия протекают гораздо быстрее, чем происходят изменения на границах системы (то есть изменения внешних по отношению к системе условий), и осуществляется обмен системы с окружением веществом и энергией.
Термодинамические параметры физ. величины, характеризующие состояние термодинамич. системы: темп-pa, давление, уд. объём, намагниченность, электрич. поляризация и др. Различают э к с т е н с и в н ы е П. с., пропорц. массе системы, и и н т е н с и в н ы е П. с., не зависящие от массы системы. К экстенсивным П. с. относятся объём, внутренняя энергия, энтропия, энтальпия, Гиббса энергия, Гельмгольца энергия (свободная энергия), к интенсивным — давление, темп-pa, концентрация, магн. индукция и др.
16. Ур-ние состояния идеального газа.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. -объём частицы газа равен нулю
-импульс передается только при соударениях
-суммарная энергия частиц газа постоянна
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
![]() где
P
— давление, n—
концентрация частиц, k—
постоянная Больцмана, T
— абсолютная температура.
где
P
— давление, n—
концентрация частиц, k—
постоянная Больцмана, T
— абсолютная температура.
![]()
![]()
В
случае постоянной массы газа уравнение
можно записать в виде:
![]()
![]()
Последнее
уравнение называют объединённым газовым
законом. Из него получаются законы
![]()
![]() Бойля-Мариотта
Бойля-Мариотта
![]() Гей-Люссака
Гей-Люссака
19.Барометрическая Формула.
В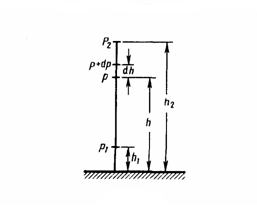 ыведем
закон изменения давления с высотой,
предполагая при этом, что масса всех
молекул одинакова, поле тяготения
однородно и температура постоянна. Если
атмосферное давление на высоте h равно
р , то на высоте h+dh оно равно p+dp (при dh>0
dp<0, так как давление с высотой
уменьшается). Разность давлений р и p+dp
равна весу газа, заключенного в объеме
цилиндра высотой dh с основанием площадью
1 м2:
ыведем
закон изменения давления с высотой,
предполагая при этом, что масса всех
молекул одинакова, поле тяготения
однородно и температура постоянна. Если
атмосферное давление на высоте h равно
р , то на высоте h+dh оно равно p+dp (при dh>0
dp<0, так как давление с высотой
уменьшается). Разность давлений р и p+dp
равна весу газа, заключенного в объеме
цилиндра высотой dh с основанием площадью
1 м2:
![]()
где
ρ — плотность газа на высоте h (dh настолько
мало, что при изменении высоты в этом
интервале плотность газа можно считать
постоянной). Значит,
![]()
Зная
уравнение состояния идеального газа
pV=(m/M) RT (m — масса газа, М — молярная масса
газа), находим, что![]() Подставив это выражение в (1), получим
Подставив это выражение в (1), получим![]() С изменением высоты от h1 до h2 давление
изменяется от р1 до р2 , т. е.
С изменением высоты от h1 до h2 давление
изменяется от р1 до р2 , т. е.
![]() или
или
![]() ЭТО
Выражение называется барометрической
формулой. Она позволяет вычислить
атмосферное давление в зависимости от
высоты или, измеряя давление, найти
высоту
ЭТО
Выражение называется барометрической
формулой. Она позволяет вычислить
атмосферное давление в зависимости от
высоты или, измеряя давление, найти
высоту
