
Лаб. раб. 1
ТЕРМОХИМИЯ. ОПРЕД-Е ТЕПЛ-ГО ЭФФЕКТА Р-ЦИИ ДЕГИДРАТ-И И ГИДРАТООБРАЗОВ-Я
Цель: 1.Опр. тепловой эфф. р-ции дегидратации сульфата меди (медн. купор.) и темпер. дегидр-и; рассч. энтропию и энергию Гиббса для этой р-ции. 2. Опр. тепловой эфф. р-ции растворения получ-й безводной соли (сульфата меди) калориметрич. методом.
Раздел хим-ой термодинамики, посвящ-й изуч-ю тепловых эфф-в хим. р-ции, теплоемкостей в-в и др., связанных с ними величин, наз-ся термохимией.
В осн. изучения термохим-х проц-в лежит 1-й закон термодинамики, закон сохранен. и превращен. энергии.
Согласно 1-му закону термодинам. теплота G, поглощаемая системой при переходе из начального состояния в конечн., идет на увеличение ее внутр. эн-гии U и на совершение работы против внешн. сил: A = p(V2-V1); G= U + pΔV
Суммарный тепл-й эфф. хим. р-ции не зависит от промежуточных состояний и пути перехода, а зав. от начального и конечного сост-я сист-ы при определ. условии протекания процесса. Так определяется закон Гесса.
Следствия из закона Гесса:
1.Тепловой эфф. хим. р-ции равен сумме теплот образования прод-в хим. р-ции без суммы теплот образования исх-х в-в с учетом стехиометрич-х коэфф-в; 2.Тепловой эфф. хим. р-ции равен сумме теплот сгорания исх-х в-в без суммы теплот сгорания прод-в р-ции с учетом стехиометрических коэфф-в; 3.Тепловой эфф. разложения равен по абсолютной величине и противоположен по знаку тепловому эфф. его образования; 4.Если осущ-ся 2 хим. р-ции, кот. приводят из разных начальных состояний в одинак. конечные, то разность тепл-х эфф-в этих р-ций предст. собой тепл-й эффе. перехода из одного конечного сост-я в др.; 5.Если осуще-ся 2 хими. р-ции, кот. приводят из одинаковых начальных состояний в различн. конечные, то разность тепл-х эфф. хим. р-ций будет предст-ть тепл-й эфф. перехода из одного конечного сост-я в др.
Выполнение работы.
На аналитич. весах взвешиваем пустой фарфор-й тигель. Растираем и взвешиваем в нем 10 г медного купороса, ставим его на электроплитку и нагр. до пост-й массы, образования безводн. соли сульфата меди. Пост-ю массу опр-м путем неск-х взвешиваний тигля с солью, до тех пор, пока масса порошка будет пост-й. Все взвешивания проводят при полном охлаждении тигля! Теоретич. расчет дегидрат. медного купороса проводим по ур-ю: CuSO4·2H2O = CuSO4 + 2Н2О + G. Эксперим-но определяемую величину потери воды сравниваем с теоретич-й, опред. процент ош. В калориметр залив. 50 мл воды, опред. температ. с точн-ю до 0,01°С. Обезвоженную соль сульфата меди, получ-ю в 1-м опыте, засыпаем в калориметр, быстро перемеш-м (потеря тепла!) и закрываем его крышкой. Отмечаем температ. р-ра после растворения соли, опр. тепл-й эфф. хим. р-ции гидратации соли. Рассчитать:
ΔН - тепловой эффект химической реакции дегидратации медного купороса;
ΔS - изменение энтропии химической реакции дегидратации медного купороса;
ΔG – эн-ю Гиббса и сделать вывод о возможности самопроизв-го протекания процесса;
- подтвердить уравнениями хим. р-ций следствия из закона Гесса.
Лаб. раб. 2
КИНЕТИКА ОПРЕД-Я СКОРОСТИ ТВЕРД. МИН-Х ВЯЖ-Х И ОЦЕНКА ВЛИЯНИЯ РАЗЛ-Х ДОБ-К НА КИНЕТИКУ ГИДРАТАЦИИ
Цель: 1.Опр-ть скорость хим. р-ции гидратации (твердения) разл-х вяж-х в завис. от конц-ции, темпер., вида доб-к. 2.Выразить графич. кинетич-ю завис-ть скорости тверд. разл-х систем.
Кинетика
- наука о скор. хим. р-ций и ее завис-ти
от разл-х факторов; природы и конц-ции
реагир-х в-в, давления, темпер. и
катализатора.
Скорость
химической реакции
- изменение конц-ции реаг-х в-в во врем.
Истинная скор. р-ции (V) в данный мом.
врем. опр-ся производной конц-ции ко
времени:
V=
dC/dt.
V=0.
Если
скор. хим. р-ции опред-ся по конц-ции
реаг-х в-в, то она убывает. Если скор.
хим. р-ции опр-ся по конц-ции продуктов
р-ции, то она больше нуля.
Для
хим. р-ции nA
+
mВ = С. Скор.
прямой р-ции выражается ур-м: V=dC/dt,
V = kC,
где
К - константа скор. хим. р-ции;
С
- изменение конц-ции реаг-х в-в.
С
увелич-м темпер. скор. хим. р-ции
возрастает. Согласно теории Аррениуса
при увелич. темпер. на каждые 10°С скор.
хим. р-ции возрастает в 2-4 раза.
Температурный коэфф- опр-ся выраж-м
Вант - Гоффа: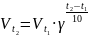
Выполнение работы.
Отвешиваем на весах навеску вяж-го или смеси. Отмеряем опред-ое кол-во воды для затворения и выливаем в чашу с сухим исследуемым в-вом. Перемеш-м. Начало отсчета врем. нач-ся с мом. окончания перемеш-я. Через каждые 30 сек (1 - 2 мин.) опр-ся глубина погр-я иглы в тесто (прибора Вика). Скор. р-ции взаимод-я вяж-го с водой будет опр-ся отношением глубины погруж. иглы в тесто ко врем. от начала затворения. Окончание р-ции опр-ся 3-мя пост-ми знач-ми глуб. погруж. Графич-е выражение скор. хим. р-ции взаимод-я мин. вяж. с водой опр-ся зависимостью скор. от врем.: V=f(t).
Вяжущие – строит. гипс, п/ц, гипсоцементные смеси. Добавки – р-ры СКС, жидкого стекла, р-р коллоидального гидроксида алюминия.
Лаб. раб. 3
ПОВЕРХНОСТНЫЕ ПРОЦЕССЫ И АДСОРБЦИЯ. ПОСТРОЕНИЕ ИЗОТЕРМЫ АДСОРБЦИИ УКСУСНОЙ КИСЛОТЫ АКТИВИРОВАННЫМ УГЛЕМ СТАТИЧЕСКИМ МЕТОДОМ
Цель: 1.Изучить завис-ть адсорбции от конц-ции р-ра, методику провед-я адсорбц-х проц-в на тв. адсорбенте. 2.Построить изотерму адсорбции уксусной к-ты активир-м углем.
Явл-е поглощения одним в-вом др-х в-в наз. сорбцией. Сорбция, кот. происх. на пов-ти тв. тела, наз. адсорбцией. На процесс адсорбции оказ-т влияние разл. факторы: состояние пов-ти поглотителя, природа адсорбируемого в-ва, темпер., давл., конц-ция р-ра. Завис-ть адсорбции от давл. или от содержания абсорбируемого в-ва в р-ре при зад-й темпер. выражается ур-м: Г = Г*·С/(К+С), где Г и Г* - конц-ция адсорбируемого в-ва на 1 м2 пов-ти адсорбента; Г – конц-ция в мом. равновесия; Г*- максимально возможная конц-ция или максимальная адсорбция; С - молярная конц-ция р-ра адсорбируемого в-ва в мом. адсорбционного равновесия. Завис-ть адсорбции от конц-ции выражается ур-м Фрейндлиха: Х/м = аСб, где X - общее колич-во адсорбируемого в-ва массой поглотителя (м) и, находящегося в равновесии с р-ром конц-ции С; а и б - константы.
