
Лабораторная работа №М6
КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА КОЛИЧЕСТВАСОДЕРЖАЩИХСЯ В РАСТВОРЕ ВЕЩЕСТВ
1. Цели работы
1.Получить практические навыки в определении содержания растворимых солей в воде кондуктометрическим методом.
2.Ознакомиться с принципом работы солемера.
2. Краткие теоретические сведения.
Растворы имеют большое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т. д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов. Подробнее в приложении 6.
Пример приготовления растворов с заданной концентрацией.
Необходимо приготовить 5% раствор NаСl.
1. Рассчитать массу соли, необходимую для приготовления 200 гр раствора указанной массовой доли
![]()
2. Рассчитать необходимый объём воды
![]()
3. С помощью технологических весов взвесить рассчитанное количество соли
4. Аккуратно перенести навеску соли в мерный стакан.
5. В тот же мерный стакан с солью добавить рассчитанное количество воды.
6. Перемешайте содержимое стакана до полого растворения соли.
7. Требуемый раствор готов.
Контроль содержания растворимых солей в воде (пульпе) можно осуществлять на основе зависимости, электропроводности раствора от концентрации находящейся в нем соли (в некоторых случаях щелочи или кислоты).
Кристаллические решетки солей построены из ионов. При растворении в воде или другом растворителе с большой диэлектрической проницаемостью вокруг ионов образуются гидратные (сольватные) оболочки, препятствующие их соединению в молекулы.
Полученные таким образом растворы электролитов, которые относятся к группе сильных, полностью или почти полностью диссоциированы.
В растворах электролитов электрическая энергия перeносится ионами. Способность проводить электричество xapaктеризуется сопротивлением или электропроводностью.
Сопротивление проводящей среды (проводника) R, (Ом) пропорционально его длине l (см) и обратно пропорционально поперечному сечению S (см2). Математически эти величины связаны следующим образом:
![]() (1)
(1)
где r(Ом∙См) - удельное сопротивление, равное сопротивлению проводника при l =1 см и S =1 см2.
Величина, обратная сопротивлению, называется электропроводностью и выражается
![]() (Ом-1)
(2)
(Ом-1)
(2)
Удельная электропроводность - величина, обратная удельному сопротивлению и определяется как
![]()
![]() (Ом-1·См-1)
(Ом-1·См-1)
Аналитическая зависимость удельной электропроводности от величин, характеризующих состояние однокомпонентного раствора, определяется следующим выражением:
![]()
где С - концентрация вещества в растворе;
а - коэффициент, характеризующий степень диссоциации раствора;
_ f - коэффициент электропроводности, характеризующий силы межионного взаимодействия (обычно f < 1);
U+ и U- - подвижности ионов (равны скоростям движения ионов, при напряженности электрического поля 1 В/см).
При этом физически удельная электропроводность представляет собой электропроводность I см3 раствора, помещенного между параллельными электродами площадью I см2 при расстоянии между ними 1 см.
Электропроводность водных растворов сильных электролитов в основном определяется силами межионного взаимодействия, зависящими от расстояния между ионами и от природы среды.
Наличие этих взаимодействии вызывает большее или меньшее взаимное торможение катионов и анионов и, следовательно, понижение их подвижности.
Так, удельная электропроводность сильных электролитов зависит от числа ионов в I см3 и их абсолютной скорости, при этом с увеличением концентрации соли число ионов в 1см3 растет, а их абсолютная скорость падает.
Взаимодействие этих факторов может привести к неоднозначной зависимости электропроводности от концентрации соли в растворе, что хорошо видно на рис 1.

Pиc.I. Зависимости удельной электропроводности χ от эквивалентной концентрации η водных растворов при температуре 20°С
При автоматическом контроле содержания соли в растворе рабочим участком измерения зависимости χ = f(C) обычно служит начальный участок.
Необходимо также отметить, что электропроводность раствора в значительной мере зависит от его температуры. При этом с повышением температуры электропроводность возрастает вследствие увеличения скорости ионов (в силу уменьшения торможения), а также за счет увеличения степени диссоциации. С увеличением температуры водного раствора на 1°С электропроводность увеличивается в среднем на 2-2,5%.
Кондуктометрический концентратомер
Кондуктометрия (от англ. conductivity - электропроводность), электрохимический метод анализа, основанный на изменении электропроводности растворов. Применяют для определения концентрации растворов солей, кислот, оснований, контроля состава некоторых промышленных растворов.
По типу чувствительности элемента(измерительной ячейки) методы измерения электрической проводимости делятся на контактные и бесконтактные.
Чувствительный элемент контактных кондуктометрических анализаторов представляет собой электронную ячейку, погруженную в контролируемый раствор, с помощью которой измеряется его электрическая проводимость, зависящая от состава и количества, находящихся в нем веществ.
Двухэлектродные ячейки применяются для анализа чистых разбавленных растворов с удельной электрической проводимостью до 10-5 См/м и в сигнализаторах, когда не требуется высокой точности измерения. В трехэлектродной ячейке внешние электроды соединены между собой и вместе с внутренним электродом образуют две параллельно включенные двухэлектродные ячейки. В этой ячейке мало сказываются внешние наводки. В четырехэлектродной ячейке переменное напряжение подводится к двум крайним электродам, между которыми в растворе протекает ток. Два внутренних электрода служат для измерения падения напряжения, которое создает ток на участке раствора между ними, четырехэлектродные ячейки применяют для анализа чистых растворов с удельной электрической проводимостью 10-2 - 10 См/м.
Устройство автоматического контроля содержания соли в растворе кондуктометрического типа состоит из датчика и измерительного прибора.
Датчиком служит электродная ячейка, погружаемая в контролируемый раствор, электропроводность которого зависит не только от размеров электродов и расстояния (взаимного расположения) между ними, но и от их формы и объема раствора.
Поэтому удельная электропроводность χ не равна измеренной электропроводности раствора СО , а лишь пропорциональна ей, т.е.
χ =Кω (3)
где К - постоянная датчика, зависящая только от формы и взаимного расположения электродов. Подставив в (3) выражение (2), получим соотношение
![]()
с помощью которого можно определить электрическое сопротивление R, датчика, имея в виду, что его постоянная К находится экспериментально путем определения R, на образцовом растворе, удельная электропроводность которого известна.
В кондуктометрических концентратомерах необходимо учитывать возможность электролиза, сопровождаемого переносом материала электродов в раствор и возникновением ЕДС поляризации в пограничном слое. С целью уменьшения этого эффекта электроды изготовляют из химически стойких в данном растворе материалов (планированной платины, нержавеющей стали, графита и др.), а измерения производят на переменном токе.
Датчик кондуктометрического концентратомера обладает не только активной проводимостью, но и реактивной, обусловленной емкостью пограничного слоя, электролитической емкостью раствора и геометрической емкостью электродов В связи с этим результаты измерений зависят также от частоты тока.
На рис.2 показана электрическая схема солемера, предназначенного для измерения содержания солей в воде.
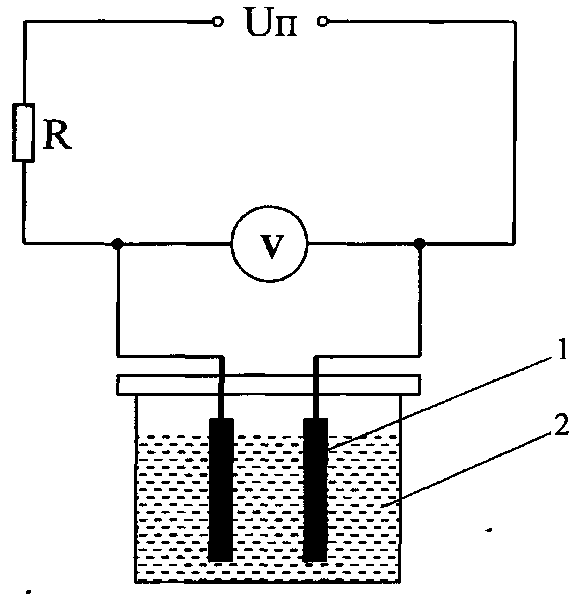
Рис.2. Схема лабораторной установки:
Графитовый стержень (электрод) датчика. 2. Солевой раствор.
Солемер представляет собой кондуктометрический концентратомер и состоит из датчика (двух электродов), вольтметра, емкости для раствора и источника питания. Электродами в датчике являются две графитовые стержни. В измерительном диапазоне солемера зависимость сопротивления датчика R (ом) от содержания соли С (мг/кг) следующая:
![]() (4)
(4)
3. Задание
I. Изучить принцип действия и устройство контроля содержания растворимых солей в воде.
2. Произвести проверку или градуировку солемера и определить его постоянную, (постоянная прибора равна числу единиц измерения, на которое следует умножить отсчет для получения показания).
3. Проанализировать полученные экспериментальные результаты.
4. Методика испытания
Для проведения испытаний необходимо собрать лабораторную установку, схема которой показана на рис.2.
Для выполнения работы необходимо погрузить электродные пары в сосуды с заранее приготовленными растворами соли NaCl известной концентрации.
Поверка шкалы прибора состоит в сопоставлении его показаний с истинными значениями концентраций раствора, которые вычисляют по данным взвешиваний при составлении растворов.
При градуировке прибора необходимо делениям его шкалы придать значения, выраженные в мг/л содержания NaCl водных растворах.
Определение постоянной прибора заключается в нахождении коэффициента, на который следует умножить отсчет для .получения показания.
Экспериментально определяют также активное сопротивление датчика. Для этого необходимо вторичный прибор подключить к магазину сопротивлений и добиться тех же показаний, что и при включенном датчике.
5. Порядок выполнения работы
1. Изучить теоретические сведения. Ознакомиться с устройством и принципом действия солемера. Собрать схему по рис.2 и включить источник питания.
2. Произвести градуировку прибора.
Для этого необходимо подготовить растворы заданной преподавателем концентрации и последовательно, по оному сосуду с датчиками (концентрация соли в растворе должна от сосуда к сосуду увеличиваться) подключать к прибору (к клеммам на передней панели стенда) и производить отсчеты по его шкале вольтметра. Необходимо произвести не менее семи измерений (первый сосуд с дистиллированной водой, последний с водопроводной),
3. Полученные результаты измерений занести в протокол 1испытаний солемера.
Протокол 1
№п.п |
Содержание NaCl в растворе, мг/л |
Показание прибора, В |
1 |
|
|
2 |
|
|
… |
|
|
4. Построить график зависимости показаний шкалы прибора: U = f(CNaCl)
5. К клеммам прибора на передней панели стенда подключить магазин сопротивлений. На магазине сопротивлений подобрать такие величины сопротивлений Rм.с., при которых показания прибора будут совпадать с его показаниями при подключенном датчике (протокол 1).
6. По формуле (4) для каждого измерения определить R и постоянную прибора путем нахождения отношения
![]()
Постоянную прибора К необходимо также определить путем нахождения отношения
K = CNaCl раствора / СNaCl, по шкале прибора (6)
7. Полученные данные занести в протокол испытаний 2.
Протокол 2
№п.п. |
Содержание NaCl в растворе, мг/л |
Показание прибора, В |
Сопротивление датчика, Ом |
Постоянная прибора К |
Отклонение К, полученного по формуле (6), от его значения, найденного по формуле (5), %, относит. |
||
действительное |
по формуле (4) |
по формуле (5) |
по формуле (6) |
||||
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
