
- •Основные типы структур неорганических соединений. Вещества с молекулярной и немолекулярной структурой. Атомные, молекулярные, ионные и металлические кристаллические решетки .
- •Строение электронных оболочек атома. Волновая теория строения атома. Понятие об электронном облаке.
- •Квантовые числа как характеристика состояния электрона в атоме. Физический смысл квантовых чисел. Энергетический уровень, подуровень. Атомная орбиталь. Форма и ориентация электронных облаков.
- •Принцип Паули и емкость электронных оболочек. Правило Хунда. Порядок заполнения атомных орбиталей. Правила Клечковского. Строение электронных оболочек атомов химических элементов.
- •Химическая связь. Основные типы химической связи. Полярность связи как функция разности электроотрицательностей химических элементов.
- •Количественные характеристики химической связи: энергия связи, длина, валентный угол. Полярность связи и полярность молекулы в целом, дипольный момент молекулы.
- •Ковалентная связь. Основные положения метода валентных связей .Спиновая теория валентности. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •3) Химическая связь в методе вс является двухцентровой и локализована в области между ядрами двух атомов ее образующих.
- •Валентность и степень окисления химических элементов в их соединениях.
- •Одиночные и кратные связи. Сигма- и пи- связи.
- •Ионная связь. Простые и сложные ионы. Ионные кристаллические решетки. Концепция поляризации ионов.
- •Металлическая связь .Металлические кристаллические решетки .
- •Водородная связь. Природа и механизм образования водородной связи
- •Зависимость физических свойств веществ с молекулярной структурой от характера межмолекулярного взаимодействия. Влияние водородной связи на свойства веществ.
- •Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). Ориентационное, индукционное и дисперсионное взаимодействие.
- •Химические реакции. Классификация химических реакций. Основные задачи химической кинетики и химической термодинамики.
- •Химическая система. Функция состояния системы. Работа и теплота. Изменение внутренней энергии системы в ходе химических превращений
- •Первое начало термодинамики. Энтальпия. Изменение энтальпии в ходе химического процесса. Закон Гесса, следствие из закона Гесса. Стандартная энтальпия образования вещества
- •Катализ и катализаторы. Гомогенные и гетерогенные катализаторы. Влияние катализаторов на величину энергии активации и константу скорости реакции.
- •Растворы. Классификация дисперсных систем: истинные растворы, коллоидные растворы, грубодисперсные системы.
- •Растворимость веществ. Влияние природы растворяемого вещества и растворителя, температуры и давления на растворимость газов, твердых и жидких веществ.
- •Сильные и слабые электролиты. Степень диссоциации. Равновесие в растворах слабых электролитов. Константа диссоциации. Связь константы диссоциации со степенью диссоциации и концентраци
- •Реакции ионного обмена в растворах. Обратимые и необратимые реакции, признаки необратимости реакций
- •Труднорастворимые электролиты. Равновесие между осадком и насыщенным раствором. Произведение растворимости и растворимость веществ
- •Константа гидролиза. Степень гидролиза, связь степени гидролиза с константой гидролиза и концентрацией раствора. Факторы, определяющие глубину гидролиза солей. Совместный гидролиз.
- •Окислительно-восстановительные реакции (овр). Основные типы овр. Типичные окислители и восстановители. Составление уравнений овр методом электронного и ионно-электронного баланса.
- •Классификация и номенклатура комплексных соединений. Основные типы комплексных соединений.
- •2) По типу лигандов комплексные частицы делятся на:
- •Кислоты и основания. Влияние положения элемента в периодической системе и степени окисления элемента на состав и кислотно-основные свойства гидроксидов элементов
- •Классификация реакций органических соединений по характеру химических превращений
- •Конформация
- •Методы масс-спектрометрии
- •Инфракрасные (ик) спектры и комбинационное рассеяние света
- •Спектроскопия в видимой и ультрафиолетовой (уф) областях
- •Рентгеновские методы исследования
- •Метод ямр
- •Общая характеристика титриметрический (объемный) метод анализа
- •Кислотно-основное титрование (метод нейтрализации) Общая характеристика метода
- •Перманганатометрия
- •Комплексонометрия Общая характеристика метода
- •Условия проведения комплексонометрического титрования
- •Гравиметрический (весовой) метод анализа
- •Электрохимические методы анализа
- •Фотометрический метод анализа Основные законы и формулы
Сильные и слабые электролиты. Степень диссоциации. Равновесие в растворах слабых электролитов. Константа диссоциации. Связь константы диссоциации со степенью диссоциации и концентраци
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как:HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. Степень диссоциации α равна отношению числа диссоциированных молекул n к сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы.
Исходя
из определения степени диссоциации,
для электролита КА в реакции диссоциации
[A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α
— степени диссоциации электролита.
Тогда:![]()
Это выражение называют законом разбавления Оствальда - соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Константа диссоциации не зависит от концентрации раствора.
Основные представления теории растворов сильных электролитов. Истинная и кажущаяся степень диссоциации в растворах. Концентрация и активность ионов. Коэффициент активности. Ионная сила растворов электролитов
Теория электролитической диссоциации включает несколько положений.
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). a = n / N 0<a<1
Величина степени диссоциации не характеризует реальную, "истинную" степень диссоциации, а пред¬ставляет некоторую кажущуюся величину.
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам). Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.тСтепень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): a = n / N и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
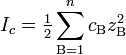 где
cB
— молярные концентрации отдельных
ионов (моль/л), zB
заряды ионов.
где
cB
— молярные концентрации отдельных
ионов (моль/л), zB
заряды ионов.
Кислоты, основания, амфотерные гидроксиды, соли с точки зрения теории электролитической диссоциации. Диссоциация солей средних, кислых, основных. Ступенчатая диссоциация. Теории кислот и оснований Аррениуса, Бренстеда, Льюиса.
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Безкислородные, кислородные, одно-, двух-, трех-, четырехосновные, сильные, слабые, устойчивые, неустойчивые, органические, неорганические, летучие, нелетучие, растворимые, нерастворимые.
Основания — (осно́вные гидрокси́ды) — сложные вещества,которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Растворимые, нерастворимые, одно-, двух- и трехкислотные, летучие, нелетучие, стабильные, нестабильные, сильные, слабые, кислородосодержащие, безкислородные.(аммиак, амины).
Амфоте́рные гидрокси́ды — химические вещества, которые в кислой среде ведут себя как основания, а в щелочной — как кислоты. Подобные свойства имеют элементы А-групп — Be, Ga, Ge, Sn, Pb, Sb, Bi и другие, а также большинство элементов Б-групп — Cr, Mn, Fe, Zn, Cd и другие. Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода и гидроксид-ионы.
Кислыми солями называют соли, которые образуются в результате неполного замещения атомами металлов атомов водорода в молекулах кислот.
Основными солями называются соли, в молекулах которых, кроме кислотных остатков, имеются также гидроксогруппы.
Средними солями называются соли, которые образуются при замещении атомов водорода в молекулах кислот двумя различными металлами.
Ступенчатая диссоциация характеризуется тем, что распад электролита на каждой последующей ступени происходит в меньшей степени, чем на предыдущей. Такой характер изменения констант диссоциации мож–но объяснить электростатическим притяжением.
Согласно теории Аррениуса, кислоты — это вещества, при электролитической диссоциации в водном растворе образующие катионы водорода Н+ и анионы кислотного остатка. Основания — это вещества, в водном растворе подвергающиеся электролитической диссоциации с образованием катионов металла и гидроксид-анионов ОН− Несмотря на то, что данная теория является довольно примитивной (не рассматривает ряд закономерностей), для простых лабораторных рассчетов она вполне достаточна. В рамках этой теории за своеобразный стандарт принята вода (pH=7). К тому же, будет происходить процесс автопротолиза.
Согласно теории Брёнстеда, кислота — это соединение, способное отдавать основанию катионы водорода Н+ (является донором протонов). Основания — это соединения, способные принимать у кислоты катионы водорода Н+ (является акцептором протонов). Таким образом, в этой теории одно и то же вещество в зависимости от взаимодействия может быть и кислотой, и основанием. Например, вода при взаимодействии с протоном H2O + H+ = H3О+ является основанием, а реагируя с аммиаком NH3 + H2O = NH4+ + OH− — является кислотой.
В теории Льюиса было ещё более расширено понятие кислоты и основания. Кислота — это молекула, имеющая вакантные электронные орбитали, вследствие чего она способна принимать электронные пары, например BF3, AlCl3. Основание — это молекула, способная быть донором электронных пар. Например, основания Льюиса — все анионы, аммиак и амины, вода, спирты, галогены.
