
Задача 1
Определить энергию активации и лимитирующую стадию растворения азота в жидкой стали, используя нижеприведенные данные по кинетике растворения азота в данной стали , при давлении азота 1 атм. И заданных температурах .
Исходные данные:
Сталь 10 |
С=0,07%-0,14%; Si=0,17%-0,37%, Mn=0,35%-0,65%, Cr≤0,15%, Ni≤0,30%, Cu≤0,30%, P≤0,035%, S≤0,04%, As≤0,08%, N≤0,008% |
τ = (мин) |
0 |
5 |
10 |
15 |
20 |
25 |
1873 |
0,002 |
0,013 |
0,022 |
0,025 |
0,029 |
0,035 |
1973 |
0,002 |
0,015 |
0,025 |
0,03 |
0,034 |
0,039 |
Решение:
1. Пусть процесс в целом лимитируется химическим звеном:
[N]p при заданных температурах вычислим , используя уравнение
Чипмана – Корригана :
![]()
Для стали сталь 10:
lg[%N]1873= -1,37
[N]p1873 = 0,043%
lg[%N]1973= -1,36
[N]p1973 = 0,044%
Для упрощения обозначим
![]()
Таблица 1 (см. график 1 )
τ = (мин) |
0 |
5 |
10 |
15 |
20 |
25 |
1873 lnA |
0 |
0,53 |
1,04 |
1,24 |
1,54 |
2,18 |
1973 lnA |
0 |
0,62 |
1,20 |
1,57 |
1,96 |
2,72 |
Определим константу скорости k по угловому коэффициенту прямой (график 1 ).
![]()
![]()
Тогда :
![]()
2.Пусть процесс в целом лимитируется внутренним массопереносом.
Запишем кинетическое уравнение :
![]()
Получим :
![]()
Обозначим
![]()
Таблица 2(см. график 2)
τ = (мин) |
0 |
5 |
10 |
15 |
20 |
25 |
1873 lnA1 |
0 |
0,31 |
0,67 |
0,82 |
1,07 |
1,63 |
1973 lnA1 |
0 |
0,37 |
0,79 |
1,10 |
1,44 |
2,13 |
Определим энергию активации :
![]()
![]()
![]()
График 1

График 2

Графически нельзя определить, в каких координатах опытные данные ложатся на прямую линию. Для сравнения используем коэффициент корреляции r . Связь лучше при большем значении r .
Таблица 1
Гипотеза о лимитирующем звене |
Значение коэффициента корреляции r |
Значение энергии активации E |
Температура Т |
Химико-адсорбционный акт |
0,97 0,99 |
63 кДж/моль |
1873 1973 |
Внутренняя диффузия |
0,973 0,983 |
75 кДж/моль |
1873 1973 |
Вывод : Исходя из данных таблицы 1 , можно предположить, что процесс растворения азота в жидкой стали при данных температурах, скорее всего протекает в смешанном режиме, который в свою очередь определяется внутренней диффузией.
Задача 2
Рассчитать коэффициент диффузии серы в жидком железе и его температурную зависимость по результатам экспериментального исследования диффузии капиллярным методом. Значения концентрации серы (%) на расстоянии Х от поверхности жидкого расплава в капилляре, а также время и температуры представлены ниже. Длина капилляра 0,1 м, диаметр 0,001 м. Время Четыре часа и пять минут
T,k |
1823 |
1923 |
X, м |
[S],% |
|
0,02 |
0,213 |
0,204 |
0,04 |
0,133 |
0,135 |
0,06 |
0,062 |
0,068 |
0,08 |
0,021 |
0,026 |
0,10 |
0,005 |
0,008 |
Решение:
В результате логарифмирования второго уравнения Фика получим:
![]()
Определим коэффициент диффузии серы в жидком металле:
T=1823 |
|
|
X |
|
-lnC |
0,02 |
0,0004 |
1,546 |
0,04 |
0,0016 |
2,017 |
0,06 |
0,0036 |
2,781 |
0,08 |
0,0064 |
3,863 |
0,10 |
0,0100 |
5,298 |
T=1923 |
|
|
X |
|
-lnC |
0,02 |
0,0004 |
1,590 |
0,04 |
0,0016 |
2,002 |
0,06 |
0,0036 |
2,688 |
0,08 |
0,0064 |
3,650 |
0,10 |
0,0100 |
4,828 |
Рассчитываем коэффициент диффузии по формуле при температуре 1873 К:
![]()
Рассчитываем коэффициент диффузии по формуле при температуре 1973 К:
![]()
tgα находим из графика 1,
который строим в координатах “![]() ”
”
График1

Определим энергию активации по угловому коэффициенту прямой, построенной в координатах “ln D – 1/T”:
1/T= |
0,000534 |
0,000507 |
lnD= |
-16,93 |
-16,78 |
График 2

![]()
![]()
Ответ:
коэффициент диффузии серы в жидком железе при Т=1873 К
![]()
коэффициент диффузии серы в жидком железе при Т=1973 К
![]()
температурная зависимость
![]()
Задача 3
Железоуглеродистый расплав обдувают
кислород содержащей газовой смесью с
постоянным расходом (qo2=0,227
![]() ).Провести
кинетический анализ процесса
обезуглероживания металла ; определить
константы скорости , энергию активации
и лимитирующее звено процесса .
).Провести
кинетический анализ процесса
обезуглероживания металла ; определить
константы скорости , энергию активации
и лимитирующее звено процесса .
Исходные данные :
Результаты проб металла на содержание углерода (%), отобранных по ходу кислородной продувки на двух плавках, проведенных при температурах 1823 К и 2023 К.
Таблица 1
Содержание углерода в %
T |
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
24 |
27 |
30 |
1823 |
0,9 |
0,75 |
0,60 |
0,45 |
0,312 |
0,214 |
0,147 |
0,101 |
0,07 |
0,048 |
0,033 |
2023 |
0,9 |
0,731 |
0,562 |
0,394 |
0,234 |
0,135 |
0,077 |
0,044 |
0,026 |
0,015 |
- |
Решение:
1. Построим кинетические кривые [С] - t при двух указанных температурах T1 =1823 К и Т2 = 2023 К (смотри график 1). Из графика 1 не видно, что кинетические кривые отклоняются от прямой при критических концентрациях углерода [С]кр, лежащих в интервале от 0.2 до 0.35%. Значения [С] далее будут уточнены (смотри график 2, 3 ).
2. Определим из графика 1 значения константы скорости k1, при 1823 К и 2023 К для высоких концентраций углерода [С] > [С]кр.
![]()
![]()
![]()
3. Энергию активации процесса обезуглероживания при [С] > [С]кр найдем по формуле
![]()
Независимость скорости обезуглероживания от концентрации углерода, ее постоянство при высоких [С] > [С]кр , а также величина энергии активации Е1 = 19,9 кДж/моль, находящаяся в интервале энергии активаций, характерных для внешнедиффузионного контроля (от 10 до 20 кДж/моль) , говорят о том, что до [C]кр процесс определяется внешним массопереносом – доставкой газообразного кислорода в зону реакции.
4. Отложим на графике значения – 1n[С], против t (смотри график 1)
Таблица 2
Ln[C]= |
0,105 |
0,288 |
0,511 |
0,799 |
1,165 |
1,542 |
1,917 |
2,293 |
2,659 |
3,037 |
3,411 |
t= |
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
24 |
27 |
30 |
Из графиков 2 и 3 видно, что
уравнение
![]() ,
отвечающее лимитированию процесса
внутренним
массопереносом, хорошо описывает
экспериментальные данные для больших
времен и малых [С] - прямолинейный участок
кривых “-1n[С]-t”.
Излом прямых
“-1n[С]-t”
происходит при 1n[С]1823
=-0,799 и 1n[С]2023
=-0,931
,
отвечающее лимитированию процесса
внутренним
массопереносом, хорошо описывает
экспериментальные данные для больших
времен и малых [С] - прямолинейный участок
кривых “-1n[С]-t”.
Излом прямых
“-1n[С]-t”
происходит при 1n[С]1823
=-0,799 и 1n[С]2023
=-0,931
Значения константы скорости k2 определили графически, как угловой коэффициент прямолинейного участка кривой « - 1n[С] - t»
![]()
![]()
5. Значения критических
концентраций углерода [С]кр,
отвечающих переходу от внешнедиффузионного
контроля к внутри диффузионному, более
точно можно по
формуле [C]кр=![]()
[C]кр(1821)=0,44%
[C]кр(2021)=0,27%
6. Вычислим энергию активации процесса при [С] < [С]кр
![]() ,
,
что отвечает энергии активации диффузии компонентов в жидком железе, которая обычно лежит в интервале от 20000 до 80000
Дж/моль.
Таким образом, анализ кинетики процесса обезуглероживания железоуглеродистого расплава показывает, что при высоких концентрациях углерода, превышающих критические, процесс протекает во внешнедиффузионной области, то есть, контролируется внешним массопереносом - доставкой газообразного углерода в зону реакции. При низких концентрациях углерода, меньших критической [С], процесс обезуглероживания контролируется внутренним массопереносом углерода в жидком железе.
Наглядное представление о критических концентрациях углерода можно получить из графика 4, который представляет зависимость скорости обезуглероживания от концентрации углерода в расплаве во внешне и внутридиффузионной областях. График 4 может быть построен по значениям k1 и k2. Из графика. 4 видно, что до [С]кр скорость обезуглероживания постоянна Vс = k1, (внешнедиффузионная область), а при [С]<[С]кр она прямо пропорциональна концентрации углерода
Vс
=
![]() (внутридиффузионная
область).
(внутридиффузионная
область).
График 1



График 2


График 3
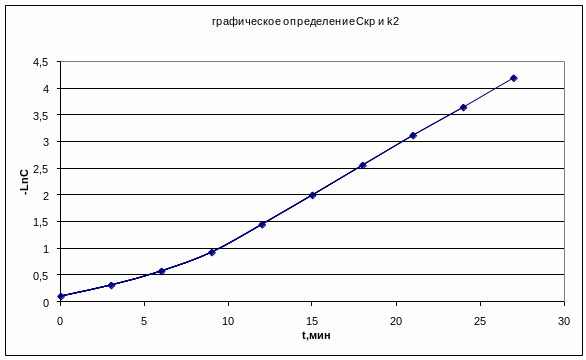

Таблица 3, Таблица 4 – зависимость Vc от [%C] при Т=1823 и 2023 К.
Таблица 3
T=1823 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
[C] |
0,9 |
0,75 |
0,6 |
0,45 |
0,312 |
0,214 |
0,147 |
0,101 |
0,07 |
0,048 |
0,033 |
|||||||||||
V |
0,050 |
0,050 |
0,050 |
0,046 |
0,033 |
0,022 |
0,015 |
0,010 |
0,007 |
0,005 |
0,011 |
|||||||||||
Таблица 4
T=2023 |
|
|
|
|
|
|
|
|
|
|
[C] |
0,9 |
0,731 |
0,562 |
0,394 |
0,234 |
0,135 |
0,077 |
0,044 |
0,026 |
0,015 |
V |
0,056 |
0,056 |
0,056 |
0,053 |
0,033 |
0,019 |
0,011 |
0,006 |
0,004 |
0,005 |
