
1.2.3 По состоянию различают:
Твёрдое — лёд
Жидкое — вода
Газообразное — водяной пар

Типы снежинок.
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твердое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию» в системе СИ). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температуравозгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
В нормальных атмосферных условиях вода закипает при температуре +98,9°С и ростом давления эта температура растёт[2].
Давление |
Ткип гр. Цельсия |
нормальные условия |
+98,9° |
1 |
+100° |
2 |
+120° |
6 |
+158° |
218,5 |
+374,1° |
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Чистая вода способна как переохлаждаться не замерзая до температур 33 градусов ниже нуля, так и быть перегрета до +200°. За это её свойсто она получила применение в промышленности.
Существует тип воды, которая имеет плотность на 40% выше нормальной и закипает при температуре +300°С. Эта разновидность воды была открыта советским учёным Б. В. Дерягиным на поверхности кристаллов кварца[2].
2. Неоргани́ческие кисло́ты — неорганические вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О+ и анионы кислотных остатков А:
НА + Н2O ↔ Н3О+ + А-
Исключение составляет борная кислота H3BO3, которая акцептирует ионы ОН−, в результате чего в водном растворе создается избыток гидроксоний-катионов:
H3BO3 + 2Н2O ↔ [B(OH)4]− + H3O+
Число отщепляемых от молекулы кислоты протонов называется основностью кислоты. Теории кислот и оснований (Брёнстеда, Льюиса и др.) кроме указанных выше относят к кислотам многие ионные соединения. Общее свойство кислот — способность реагировать с основаниями и основными оксидами с образованием солей, например:
HNO3 + NaOH → NaNO3 + H2O
2HCl + CaO → CaCl2 + H2O
1. взаимодействие оксидов (ангидридов) с водой, например:
Р2O5 + 3Н2O → 2Н3РО4
2. вытеснение более летучей кислоты из ее соли менее летучей кислотой, например:
CaF2 + H2SO4 → CaSO4 + 2HF
3. гидролиз галогенидов или солей, например:
PI3 + 3Н2O → Н3РО3 + 3HI
Al2Se3 + 6H2O → 2Al(ОН)3 + 3H2Se
замена катионов растворенных солей на Н+ с помощью катионита. Существует также множество др. методов получения кислот.
Кислоты применяют в промышленности и в научных исследованиях. В больших количествах производят серную кислоту, азотную кислоту, фосфорную кислоту, соляную кислоту и др.
Со́ли —
класс химических соединений, к которому
относятся вещества,
состоящие из катионов металла (или
катионов аммония ![]() ;
известны соли фосфония
;
известны соли фосфония ![]() или гидроксония
или гидроксония ![]() )
и анионов кислотного
остатка.
)
и анионов кислотного
остатка.
Типы солей
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример:
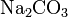 ,
, 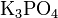 .
.Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример:
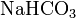 ,
,  .
.Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример:
 .
.Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример:
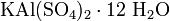 .
.Смешанные соли — в их составе присутствует два различных аниона. Пример:
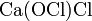 .
.Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример:
 .
.Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример:
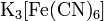 ,
,  .
.
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
Нахождение в природе
Многие минералы —
соли, образующие залежи
(например, галит ![]() , сильвин
, сильвин ![]() , флюорит
, флюорит ![]() ).
).
Названия солей образуются
из двух слов: название аниона в именительном
падеже и название катиона в родительном
падеже: ![]() — сульфат
натрия.
Для металлов с переменной степенью
окисления её
указывают в скобках и без пробела:
— сульфат
натрия.
Для металлов с переменной степенью
окисления её
указывают в скобках и без пробела: ![]() — сульфат
железа(II),
— сульфат
железа(II), ![]() — сульфат
железа(III).
— сульфат
железа(III).
Названия кислых
солей начинаются
с приставки «гидро-» (если в соли
присутствует один атом водорода)
или «дигидро-» (если их два).
Например,
— гидрокарбонат
натрия, ![]() — дигидрофосфат
натрия.
— дигидрофосфат
натрия.
Названия основных
солей начинаются
с приставки «гидроксо-» или «дигидроксо-».
Например, ![]() —
гидроксохлорид магния,
—
гидроксохлорид магния, ![]() —
дигидроксохлорид алюминия.
—
дигидроксохлорид алюминия.
В гидратных
солях на
наличие кристаллической воды указывает
приставка «гидрат-». Степень гидратации
отражают численной приставкой.
Например, ![]() —
дигидрат хлорида кальция.
—
дигидрат хлорида кальция.
На
низшую степень окисления кислотообразующего
элемента (если их больше двух) указывает
приставка «гипо-». Приставка «пер-»
указывает на высшую степень окисления
(для солей кислот с окончаниями «-овая»,
«-евая», «-ная»). Например: ![]() — гипохлорит
натрия,
— гипохлорит
натрия, ![]() — хлорит
натрия,
— хлорит
натрия, ![]() — хлорат
натрия,
— хлорат
натрия, ![]() — перхлорат
натрия.
— перхлорат
натрия.
Методы получения
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:
![]()
![]()
![]()
Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
![]()
![]()
![]()
![]()
![]()
Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
![]()
![]()
![]()
Взаимодействие простых веществ:
![]()
Взаимодействие оснований с неметаллами, например с галогенами:
![]()
]Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
![]()
![]()
![]()
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
![]()
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменениемстепеней окисления атомов реагентов:
![]()
![]()
![]()
Некоторые соли разлагаются при нагревании:
![]()
![]()
![]()
![]()
[править]Применение солей
Соли повсеместно используются как в производстве, так и в повседневной жизни.
Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция инитрат аммония. Обычно эти соли называют селитрами.
Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Катио́н — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4+ — однозарядный катион, Ca2+ — двузарядный катион. В электрическом поле катионы перемещаются к отрицательному электроду — катоду.
Анио́н — отрицательно заряженный ион. Характеризуется величиной отрицательного электрического заряда; например, Cl− — однозарядный анион, а SO42− — двузарядный анион. В электрическом поле анионы перемещаются к положительному электроду — аноду. Анионы имеются в растворах большинства солей, кислот и оснований, а также в кристаллических решетках соединений с ионной связью, в ионных жидкостях и в расплавах.
