
- •Лабораторная работа №1. Исследование теплоемкости твердых тел в интервале температур от 350 к до 900 к.
- •Краткая теория.
- •Молекулярная теплоемкость химических соединений в твердом состоянии
- •Теория метода и описание установки.
- •Задание 1. Получение экспериментальных данных по температуре (т) и времени (t) охлаждения образца.
- •Задание 2. Нахождение производных в окрестностях температур.
- •Задание 3. Определение удельной теплоемкости железа и алюминия. Построение графика зависимости молярной теплоемкости от температуры.
- •Задание 4. Определение коэффициента теплоотдачи.
- •2. Определение газовой постоянно r.
- •3. Проверка первого начала термодинамики.
- •Описание установки:
- •Порядок выполнения работы:
- •Обработка результатов измерений:
- •Контрольные вопросы:
- •Лабораторная работа № 3 Определение отношения Ср/Сv (для воздуха методом Клемана - Дезорма).
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №4 «Определение отношения молярных теплоемкостей Ср/Сv методом измерения скорости звука»
- •Порядок выполнения работы.
- •Контрольные вопросы
- •Лабораторная работа №5. Изучение зависимости сопротивления проводника и полупроводника от температуры. Определение энергии активации полупроводника.
- •Методические указания
- •Описание установки
- •Порядок выполнения работы Задание 1
- •Задание 2
- •Литература
2. Определение газовой постоянно r.
Запишем уравнение Менделеева-Клапейрона:
![]() , (2.3)
, (2.3)
где
R
- газовая постоянная;
![]() -
объем газа;
-
объем газа;
![]() - масса газа;
- масса газа;
![]() - молярная масса газа;
- молярная масса газа;
![]() - термодинамическая температура газа.
- термодинамическая температура газа.
Постоянная
![]() одинакова для всех газов. Выразим ее из
(2.3):
одинакова для всех газов. Выразим ее из
(2.3):
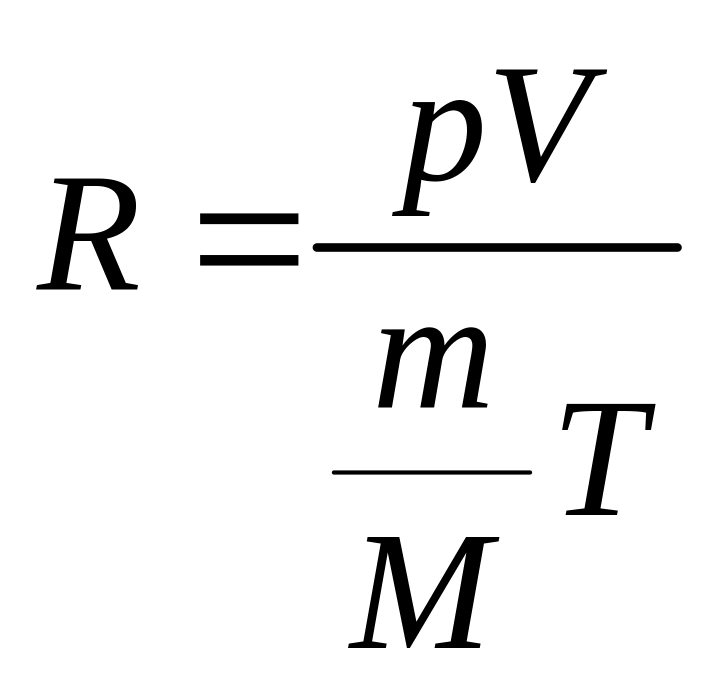 , (2.4)
, (2.4)
где - объем воздуха в колбе вместе с подводящими трубками при комнатной температуре.
Объем легко вычислить, если рассмотреть уравнение Менделеева-Клапейрона для двух различных состояний газа:
при комнатной температуре
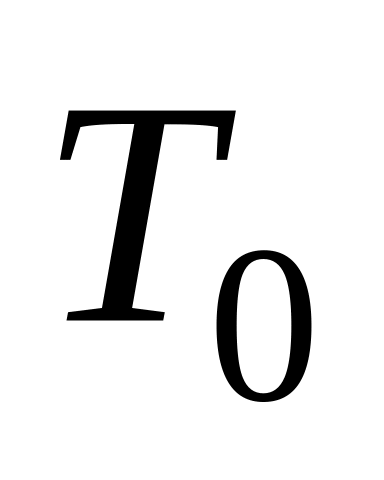 :
:
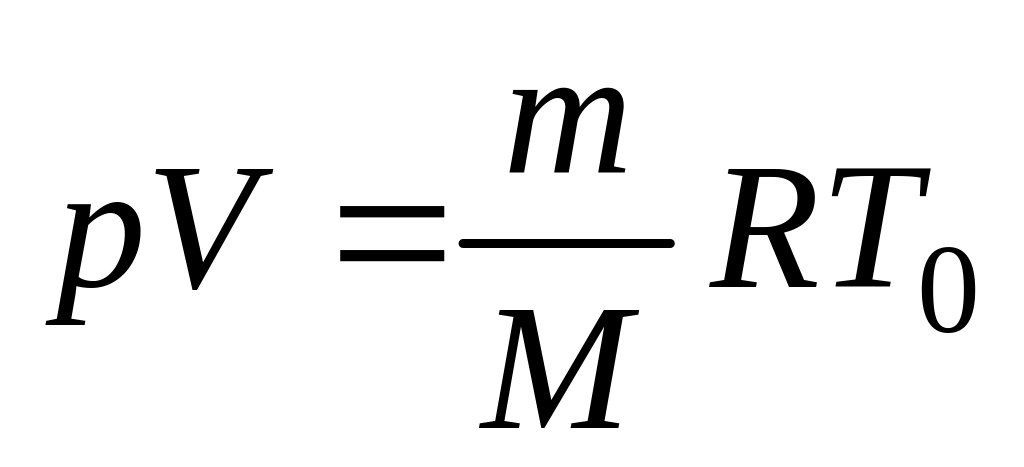 (2.4)
(2.4)при температуре
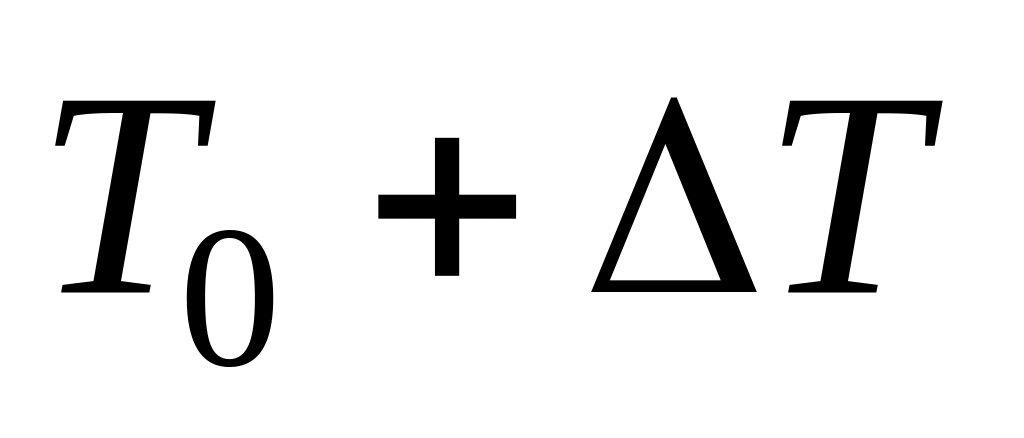 :
:
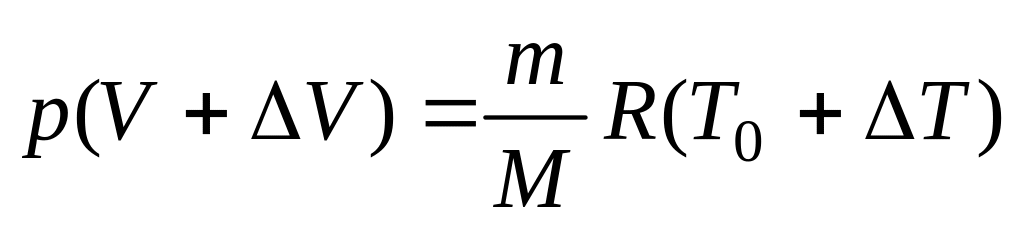 . (2.5)
. (2.5)
Поделив
уравнение (2.5) на уравнение (2.4), получим:
![]() ,
откуда объем V
газа равен:
,
откуда объем V
газа равен:
![]() . (2.6)
. (2.6)
Учитывая,
что масса газа может быть найдена как
произведение плотности воздуха
![]() на объем
,
окончательно получим:
на объем
,
окончательно получим:
![]() , (2.7)
, (2.7)
где
![]() ;
- приращение температуры, выбранное
экспериментатором.
;
- приращение температуры, выбранное
экспериментатором.
Так как нагрев воздуха происходит при постоянном давлении, то, продифференцировав уравнение Менделеева-Клапейрона по объему, получим:
![]() ,
откуда
,
откуда
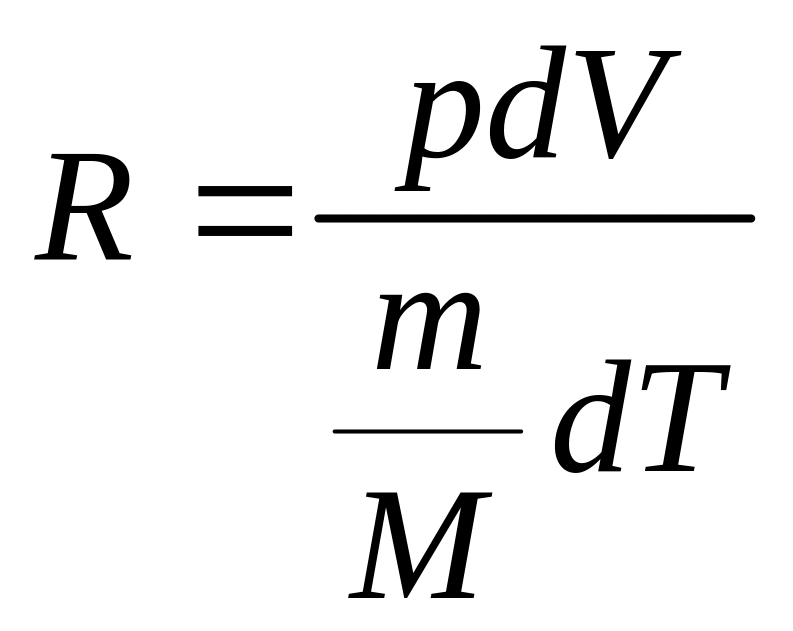 (2.8)
(2.8)
Газовая
постоянная
R
численно равна работе одного моля газа
при изобарном нагревании его на один
градус. Следовательно, зная работу
расширения газа можно найти постоянную
из соотношения (2.8). Однако в нашей работе,
чтобы исключить ошибки при измерениях
и
![]() рекомендуется определить газовую
постоянную при исследовании зависимости
изменения объема газа от температуры
рекомендуется определить газовую
постоянную при исследовании зависимости
изменения объема газа от температуры
![]() ,
которая представляет собой уравнение
Менделеева-Клапейрона, записанное в
виде:
,
которая представляет собой уравнение
Менделеева-Клапейрона, записанное в
виде:
![]() (2.9)
(2.9)
Величина,
равная
![]() ,
является постоянной в данной лабораторной
работе. Введем обозначение:
,
является постоянной в данной лабораторной
работе. Введем обозначение:
![]() , (2.10)
, (2.10)
где - масса газа, найденная ранее, - атмосферное давление.
Выразим из (2.10) газовую постоянную R:
![]() , (2.11)
, (2.11)
Учитывая (2.10), выражение (2.9) можно представить в виде:
![]() (2.12)
(2.12)
Выражение
(2.12) представляет собой уравнение прямой,
для которой
![]() - угловой коэффициент.
- угловой коэффициент.
Таким образом, построив по экспериментальным данным график зависимости объема от температуры можно определить значение углового коэффициента , равного тангенсу угла наклона, а затем, используя выражение (2.11) рассчитать значение газовой постоянной R.
3. Проверка первого начала термодинамики.
Согласно
первому началу термодинамики, при
изобарном нагревании газ поглощает
некоторое количество тепла
![]() равное сумме
равное сумме
![]() (2.13)
(2.13)
где ∆U - изменение внутренней энергии газа, равное
![]() , (2.14)
, (2.14)
где i - число степеней свободы молекул газа, ∆T- изменение температуры газа, - работа расширения газа.
При постоянном давлении:
![]() (2.15)
(2.15)
В данной работе по результатам измерений можно рассчитать величины работы А, изменения внутренней энергии ∆U, количества теплоты и, подставив в выражения (2.12), сравнить левую и правую части.
Замечание: для вычисления можно воспользоваться процентным соотношение между работой и количеством теплоты при изобарном процессе:
![]() , (2.16)
, (2.16)
Выражение (2.16) легко получить, применив первое начало термодинамики к изобарному процессу для двухатомного газа.
Сравните полученное значение количеством теплоты с расчетным по формуле (2.15).
