
7. Теплоёмкость идеального газа
Как
показывают результаты экспериментов,
во многих случаях приращение температуры
тела прямо пропорционально количеству
теплоты, сообщенного ему. Для количественного
описания этого соотношения вводится
коэффициент
пропорциональности
![]() между
количеством теплоты, сообщаемого телу,
и изменением его температуры, называемым
теплоёмкостью:
между
количеством теплоты, сообщаемого телу,
и изменением его температуры, называемым
теплоёмкостью:
|
(2.55) |
Этот
коэффициент позволяет определить
количество теплоты
![]() ,
которое необходимо сообщить телу для
повышения его температуры на величину
,
которое необходимо сообщить телу для
повышения его температуры на величину
![]() .
.
В самом общем случае для произвольного тела его теплоемкость может зависеть от параметров состояния этого тела, например, от его температуры или объема. Очевидно, что теплоемкость термодинамической системы изменяется при изменении количества вещества в ней. Для систем, находящихся в состоянии термодинамического равновесия, их теплоемкость пропорциональна количеству вещества. Это позволяет ввести для описания свойств тела удельную теплоемкость:
|
(2.56) |
и, соответственно, молярную теплоемкость:
|
(2.57) |
где:
![]() -
масса тела,
-
масса тела,
![]() -
количество вещества в нем. Эти теплоемкости
связаны между собой через молярную
массу
-
количество вещества в нем. Эти теплоемкости
связаны между собой через молярную
массу
![]() следующим
соотношением:
следующим
соотношением:
|
(2.58 |
Вывести
формулу Майера СP
= СV
+ R, принимая что для идеального газа
![]() (закон
Джоуля).
(закон
Джоуля).
R - универсальная газовая постоянная.
![]()
![]() учитывая
основное термодинамическое тождество
учитывая
основное термодинамическое тождество
![]()
![]()
![]()
![]()
![]()
т. е. внутренняя энергия U не зависит от объема при фиксированной температуре.
![]()
![]()
С учетом закона Джоуля, формула Майера для идеального газа СP = СV + R .
9.
Политропический
процесс, политропный
процесс, изменение состояния физической
системы, при котором сохраняется
постоянной её теплоёмкость
(С).
Кривая на термодинамических диаграммах,
изображающая Политропический
процесс,
называется политропой.
Простейшим примером обратимого
Политропический
процесс
может служить Политропический
процесс
с идеальным
газом,
определяемый уравнением pV
n
= const, где р
— давление, V
— объем газа,
![]() показатель
политропы (Cp
и Cv
— теплоёмкости
газа соответственно при постоянном
давлении и объёме). Используя уравнение
состояния
идеального газа, уравнение политропы
можно записать в ином виде:
показатель
политропы (Cp
и Cv
— теплоёмкости
газа соответственно при постоянном
давлении и объёме). Используя уравнение
состояния
идеального газа, уравнение политропы
можно записать в ином виде:
![]() const
или
const
или
![]() const
(здесь Т —
абсолютная
температура). уравнение Политропический
процесс
идеального газа включает, как частные
случаи, уравнения: адиабаты
(С =
0,
n =
Cp/Cv,
это отношение теплоёмкостей обозначают
g), изобары
(С = Ср,
n = 0), изохоры
(С = Cv,
n = ¥) и изотермы
(С = ¥, n =
1). Работа А
идеального
газа в Политропический
процесс
против внешнего давления определяется
по формуле
const
(здесь Т —
абсолютная
температура). уравнение Политропический
процесс
идеального газа включает, как частные
случаи, уравнения: адиабаты
(С =
0,
n =
Cp/Cv,
это отношение теплоёмкостей обозначают
g), изобары
(С = Ср,
n = 0), изохоры
(С = Cv,
n = ¥) и изотермы
(С = ¥, n =
1). Работа А
идеального
газа в Политропический
процесс
против внешнего давления определяется
по формуле
![]() ,
где индексами 1 и 2 обозначены начальное
и конечное состояния газа. Понятием
Политропический
процесс
широко пользуются в технической
термодинамике при исследовании рабочих
циклов тепловых двигателей.
,
где индексами 1 и 2 обозначены начальное
и конечное состояния газа. Понятием
Политропический
процесс
широко пользуются в технической
термодинамике при исследовании рабочих
циклов тепловых двигателей.
11. Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:
![]()
где R — универсальная газовая постоянная.
Закон выводится в предположении, что кристаллическая решетка тела состоит из атомов, каждый из которых совершает гармонические колебания в трех направлениях, определяемыми структурой решетки, причем колебания по различным направлениям абсолютно независимы друг от друга. При этом получается, что каждый атом представляет три осциллятора с энергией E, определяемой следующей формулой:
![]() .
.
Формула
вытекает из теоремы о равнораспределении
энергии
по степеням свободы. Так как каждый
осциллятор имеет одну степень
свободы,
то его средняя кинетическая
энергия
равна
![]() ,
а так как колебания происходят
гармонически, то средняя потенциальная
энергия
равна средней кинетической, а полная
энергия - соответственно их сумме. Число
осцилляторов в одном моле вещества
составляет
,
а так как колебания происходят
гармонически, то средняя потенциальная
энергия
равна средней кинетической, а полная
энергия - соответственно их сумме. Число
осцилляторов в одном моле вещества
составляет
![]() ,
их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает
закон Дюлонга-Пти.
,
их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает
закон Дюлонга-Пти.
12. Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь λ, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как в движении участвует огромное число молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул {λ}. Из основных положений МКТ получена формула для определения средней длины свободного пробега:
{λ}=1/(√2)πσ2n, (40)
где σ - эффективный диаметр молекулы, n - число молекул в единице объема газа. При постоянной температуре n пропорционально давлению, следовательно, средняя длина свободного пробега обратно пропорциональна давлению газа. Эффективный диаметр молекулы - это минимальное расстояние, на которое сближаются при столкновении центры двух молекул. Эффективный диаметр больше истинного и зависит от энергии молекул, а, следовательно, и от температуры. В термодинамически неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. К таким явлениям относятся теплопроводность (обусловлена переносом энергии), диффузия (обусловлена переносом массы) и внутреннее трение, или вязкость (обусловлено переносом импульса). Каждое из явлений переноса связано с неодинаковостью в пространстве значений некоторой величины (соответственно: температуры, концентрации и скорости). Явление теплопроводности заключается в обмене энергиями между молекулами газа при их столкновении. В результате происходит процесс выравнивания средних кинетических энергий молекул, а, следовательно, температур. Перенос энергии в форме теплоты подчиняется закону Фурье:
jE = -λ(dT/dx), (41)
где jE - плотность теплового потока (количество энергии, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х), λ - коэффициент теплопроводности, dT/dx - градиент температуры, показывающий, как быстро меняется температура газа от слоя к слою на единицу длины в направлении нормали к этой площадке. Знак минус показывает, что перенос энергии происходит в сторону убывания температуры. Диффузия – самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и твердых тел. Для химически однородного газа диффузия подчиняется закону Фика:
jm = -D(dρ/dx), (42)
где jm - плотность потока массы (масса вещества, перемещающегося в единицу времени через единичную площадку, перпендикулярно оси х), D - коэффициент диффузии, dρ/dx - градиент плотности, равный скорости изменения плотности на единицу длины х в направлении нормали к этой площадке. Знак минус показывает, что перенос массы происходит в направлении убывания плотности. Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, сопровождающийся переносом импульса молекул в направлении движения слоев. В результате возникает торможение слоя, движущегося быстрее, и ускорение слоя, движущегося медленнее, что и составляет суть внутреннего трения. Экспериментально установлено, что модуль силы внутреннего трения, приложенной к слоям, подчиняется закону Ньютона:
F=η(|dv/dx|)S, (43)
где η - коэффициент вязкости, dv/dx - градиент скорости в направлении, перпендикулярном к слоям, S - площадь слоев (рис. 7).
 Рис.
7. К закону Ньютона
Рис.
7. К закону Ньютона
Коэффициент вязкости численно равен силе внутреннего трения при dv/dx=c-1 и S=1 м2. В системе СИ единицы измерения коэффициента вязкости:
[η]=Па·с=Н·с/м2
Коэффициент вязкости зависит от средней скорости молекул и длины их свободного пробега:
η=(1/3)·ρ·{v}·{λ} (44)
Из формулы (44) с учетом выражения (32) для средней скорости молекул получим следующее выражение для коэффициента вязкости:
η=(2/3)·p·√(2M{λ}/πRT) (45)
Штерна опыт
экспериментальное определение скоростей теплового движения молекул газа, осуществленное О. Штерном в 1920. Ш. о. подтвердил правильность основ кинетической теории газов (См. Кинетическая теория газов). Исследуемым газом в опыте служили разреженные пары серебра, которые получались при испарении слоя серебра, нанесённого на платиновую проволоку, нагревавшуюся электрическим током. Проволока располагалась в сосуде, из которого воздух был откачан, поэтому атомы серебра беспрепятственно разлетались во все стороны от проволоки. Для получения узкого пучка летящих атомов на их пути была установлена преграда со щелью, через которую атомы попадали на латунную пластинку, имевшую комнатную температуру. Атомы серебра осаждались на ней в виде узкой полоски, образуя серебряное изображение щели. Специальным устройством весь прибор приводился в быстрое вращение вокруг оси, параллельной плоскости пластинки. Вследствие вращения прибора атомы попадали в др. место пластинки: пока они пролетали расстояние l от щели до пластинки, пластинка смещалась. Смещение растет с угловой скоростью ω прибора и уменьшается с ростом скорости v атомов серебра. Зная ω и l, можно определить v. Т. к. атомы движутся с различными скоростями, полоска при вращении прибора размывается, становится шире. Плотность осадка в данном месте полоски пропорциональна числу атомов, движущихся с определённой скоростью. Наибольшая плотность соответствует наиболее вероятной скорости атомов. Полученные в Ш. о. значения наиболее вероятной скорости хорошо согласуются с теоретическим значением, полученным на основе Максвелла распределения (См. Максвелла распределение) молекул по скоростям.
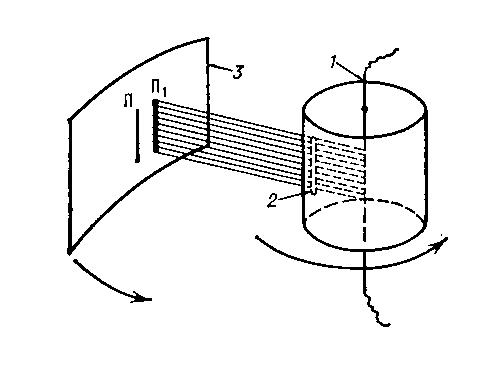
Схема опыта Штерна: 1 — платиновая проволока с нанесённым на неё слоем серебра; 2 — щель, формирующая пучок атомов серебра; 3 — пластинка, на которой осаждаются атомы серебра; П и П1 — положения полосок осажденного серебра при неподвижном приборе и при вращении прибора.
13. Диффузия лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму[1]. В некоторых ситуациях одно из веществ уже имеет выравненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (против градиента концентрации)
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения. Важную роль диффузия частиц играет в физике плазмы.
Обычно под диффузией понимают процессы, сопровождающиеся переносом материи, однако иногда диффузионными называют также другие процессы переноса: теплопроводность, вязкое трение и т. п.
Уравнения Фика
С точки зрения термодинамики движущим потенциалом любого выравнивающего процесса является рост энтропии. При постоянных давлении и температуре в роли такого потенциала выступает химический потенциал µ, обуславливающий поддержание потоков вещества. Поток частиц вещества пропорционален при этом градиенту потенциала
J
~
![]()
В большинстве практических случаев вместо химического потенциала применяется концентрация C. Прямая замена µ на C становится некорректной в случае больших концентраций, так как химический потенциал связан с концентрацией по логарифмическому закону. Если не рассматривать такие случаи, то вышеприведённую формулу можно заменить на следующую:
![]()
которая показывает, что плотность потока вещества J [cm − 2s − 1] пропорциональна коэффициенту диффузии D [(cm2s − 1)] и градиенту концентрации. Это уравнение выражает первый закон Фика (Адольф Фик — немецкий физиолог, установивший законы диффузии в 1855 г.). Второй закон Фика связывает пространственное и временное изменения концентрации (уравнение диффузии):
![]()
Коэффициент диффузии D зависит от температуры. В ряде случаев в широком интервале температур эта зависимость представляет собой уравнение Аррениуса.
Дополнительное поле, наложенное параллельно градиенту химического потенциала, нарушает стационарное состояние. В этом случае диффузионные процессы описываются нелинейным уравнением Фоккера—Планка. Процессы диффузии имеют большое значение в природе:
Питание, дыхание животных и растений;
Проникновение кислорода из крови в ткани человека.
14. Теплопрово́дность — это перенос тепловой энергии структурными частицами вещества (молекулами, атомами, ионами) в процессе их теплового движения. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества. Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, передаётся другому телу при их взаимодействии или передаётся из более нагретых областей тела к менее нагретым областям. Иногда теплопроводностью называется также количественная оценка способности конкретного вещества проводить тепло.
Численная характеристика теплопроводности материала равна количеству теплоты, проходящей через материал толщиной 1 м и площадью 1 кв.м за единицу времени (секунду) при разности температур на двух противоположных поверхностях в 1 К. Данная численная характеристика используется для расчета теплопроводности для калибрования и охлаждения профильных изделий.
Закон теплопроводности Фурье
В установившемся режиме плотность потока энергии, передающейся посредством теплопроводности, пропорциональна градиенту температуры:
![]()
где
![]() —
вектор плотности теплового потока —
количество энергии, проходящей в единицу
времени через единицу площади,
перпендикулярной каждой оси,
—
вектор плотности теплового потока —
количество энергии, проходящей в единицу
времени через единицу площади,
перпендикулярной каждой оси,
![]() —
коэффициент
теплопроводности
(иногда называемый просто теплопроводностью),
T —
температура. Минус в правой части
показывает, что тепловой поток направлен
противоположно вектору grad T (то есть в
сторону скорейшего убывания температуры).
Это выражение известно как закон
теплопроводности Фурье.[1]
—
коэффициент
теплопроводности
(иногда называемый просто теплопроводностью),
T —
температура. Минус в правой части
показывает, что тепловой поток направлен
противоположно вектору grad T (то есть в
сторону скорейшего убывания температуры).
Это выражение известно как закон
теплопроводности Фурье.[1]
15. Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Различают динамическую вязкость (единицы измерения: пуаз, 0,1Па·с) и кинематическую вязкость (единицы измерения: стокс, м²/с, внесистемная единица — градус Энглера). Кинематическая вязкость может быть получена как отношение динамической вязкости к плотности вещества и своим происхождением обязана классическим методам измерения вязкости, таким как измерение времени вытекания заданного объёма через калиброванное отверстие под действием силы тяжести.
Основной закон вязкого течения был установлен И. Ньютоном (1687):
![]()
где F — тангенциальная (касательная) сила, вызывающая сдвиг слоёв жидкости (газа) относительно друг друга; S — площадь слоя, по которому происходит сдвиг; (v2 — vl)/(z2 — z1) — градиент скорости течения (быстрота изменения её от слоя к слою), иначе — скорость сдвига (см. рис. 1). Коэффициент пропорциональности η называется коэффициентом динамической вязкости или просто В. Он количественно характеризует сопротивление жидкости (газа) смещению её слоёв. Величина, обратная В., φ =1/η называется текучестью.
Согласно формуле (1), В. численно равна тангенциальной силе PS = F/S (на единицу площади), необходимой для поддержания разности скоростей, равной единице, между двумя параллельными слоями жидкости (газа), расстояние между которыми равно единице. Из этого определения следует, что в Международной системе единиц (См. Международная система единиц) единица В. имеет размер н·сек/м2, а в СГС системе единиц (См. СГС система единиц) — г/(см2·сек) (пуаз). 1 пз = 0,1 н·сек/м2. Наряду с динамической В. η часто рассматривают так называемую кинематическую В. ν = η/ρ, где ρ — плотность жидкости или газа. Единицами кинематической В. служат, соответственно, м2/сек и см2/сек (Стокс). В. жидкостей и газов определяют Вискозиметрами.
