
- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
Гомологический ряд
Гомологический ряд ацетилена С2Н2; С3Н4; С4Н6; и т.д.
![]()
Гомологическая разность ряда -СН2-, общая формула СnH2n-2.
Изомерия
Изомерия алкинов связана с положением тройной связи
![]()
а также с изомерией углеродного скелета:

Номенклатура
Правила построения названия алкинов в системе IUPAC такие же, как и для алкенов, с той разницей, что вместо окончания -ен прибавляют окончание -ин:

Способы получения
Промышленные способы получения ацетилена
Из карбида кальция
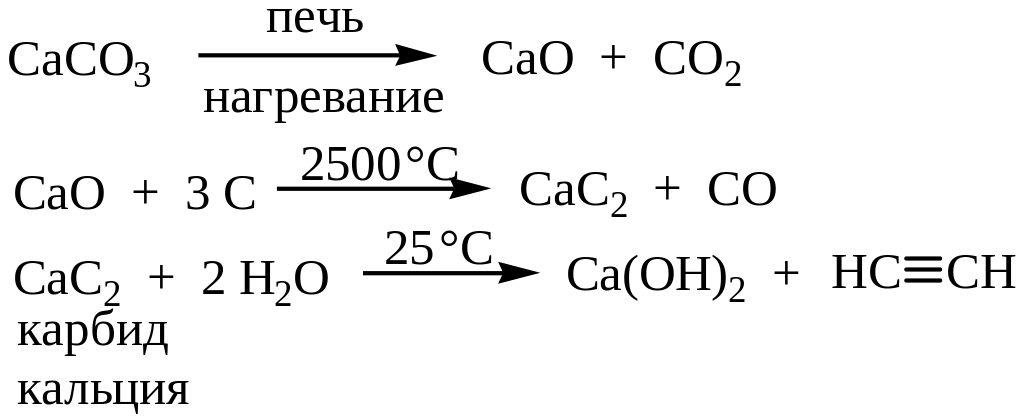
Для производства 1 кг ацетилена, требуется 1 квт/час энергии, поэтому разрабатываются другие методы синтеза: плазмохимические превращения угля, углеродсодержащих промышленных и бытовых отходов, получение ацетилена из природного газа, оксида углерода.
Пиролиз метана.
![]()
Время контакта очень небольшое (0,1 с), затем следует быстрое охлаждение. Примерно треть получаемого в США ацетилена производится таким способом.
Промышленные способы получения ацетилена можно представить в виде схемы:
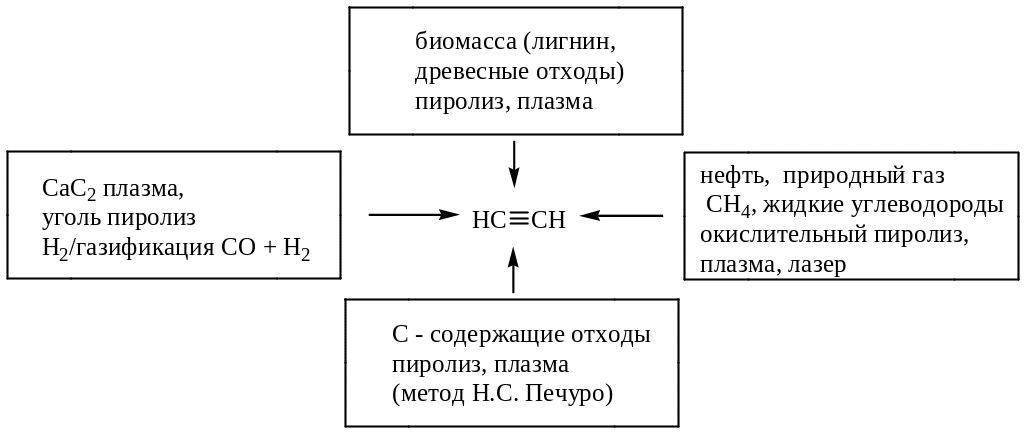
Лабораторные способы получения ацетилена и его гомологов
Лабораторные способы получения используют главным образом реакции отщепления (Е), и реакции алкилирования солей ацетилена.
1. Реакция дегидрогалогенирования:
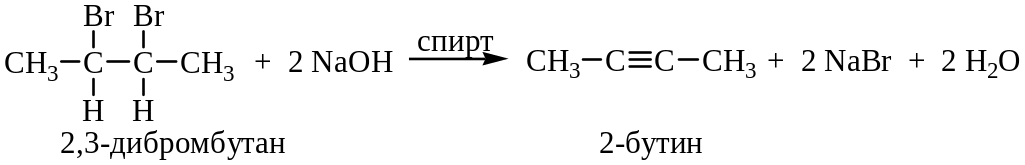
Реакцию проводят при действии концентрированной щелочи при повышенной температуре.
2. Алкилирование солей ацетилена. При взаимодействии ацетилена с амидом натрия (натрий + аммиак) образуется ацетиленид-анион, который способен вступать в реакцию с алкилгалогенидами, что приводит к образованию алкинов с концевой тройной связью:

Ацетиленид лития дает устойчивый комплекс с этилендиамином NH2CH2CH2NH2 (ЭДА), который служит удобным источником ацетиленид-анионов и в других растворителях, помимо жидкого аммиака.
HCCLi NH2CH2CH2 NH2 – комплекс ацетиленида лития с этилендиамином
Эта реакция позволяет получить алкины с концевой СС связью
Ацетиленид натрия также взаимодействует с галоидными алкилами, образуя ацетиленовые углеводороды с концевой тройной углерод-углеродной связью:
![]()
Физические свойства
Основные закономерности в изменении температур плавления и кипения в гомологическом ряду ацетиленовых углеводородов сходны с закономерностями в ряду этиленовых углеводородов.
Положение тройной связи в цепи еще более сильно влияет на температуру кипения. Так, например, 1-бутин кипит при 8,5С, а 2-бутин – при 27С, тогда как оба бутана и все бутилены при обычных условиях – вещества газообразные. Плотности и показатели преломления ацетиленов выше, чем олефинов и, тем более, парафинов.
Строение алкинов
Строение молекулы ацетилена объясняется, исходя из представления о sp-гибридизации углеродного атома
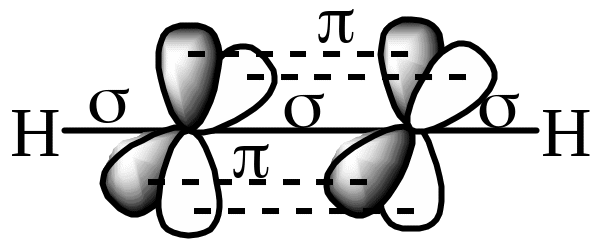
Две гибридизированные sp-орбитали ( по одной от каждого атома углерода) перекрываясь, образуют - связь. Оставшиеся негибридизированные р-орбитали располагаются во взаимно перпендикулярных плоскостях и перекрываются соответственно с аналогичными орбиталями другого sp-гибридизированного углеродного атома, формируя - связь. Каждая из этих - связей располагается во взаимно перпендикулярных плоскостях, как между собой, так и по отношению к - связи. Валентные углы равны 1800, т.е. молекула ацетилена линейна.
Линейное расположение заместителей при тройной связи алкинов исключает для них возможность цис-, транс- изомерии.
Тройная связь значительно короче двойной связи. Электронографические исследования показали, что ацетиленовая группировка имеет линейное строение:
![]()
Энергия связи СС 812×103 Дж/моль (128,5 ккал/моль), а энергия связи С-Н 543 кДж/моль, при этом связь С-Н – самая прочная среди других С-Н связей.
Ацетилен и его гомологи являются ещё более ненасыщенными, чем алкены, поэтому вполне обоснованно ожидать, что эти углеводороды в первую очередь должны вступать в реакции электрофильного присоединения. Наличие 2 -связей определяет возможность по сравнению с алкенами присоединения 2 молей реагента.
