
- •1. Законы атомно-молекулярной теории. Понятие эквивалента. Эквиваленты простых и сложных веществ.
- •2. Закон Авогадро, следствия этого закона.
- •3. Строение атома по модели Бора.
- •4. Строение электронных оболочек атомов. Атомные орбитали. Квантовые числа.
- •5. Химическая связь, ее типы и методы описания.
- •6. Понятие энтальпии. Энтальпия реакции. Энтальпия образования химических соединений.
- •7. Законы термохимии. Определение средней энергии связи.
- •8. Понятие энтропии. Стандартные значения энтропии, изменение энтропии в химической реакции.
- •9. Энергия Гиббса. Стандартные значения свободной энергии.
- •10. Направление химической реакции. Принципиальная возможность протекания процесса.
- •11. Скорость химической реакции. Кинетическое уравнение. Порядок и молекулярность реакции. Энергия активации. Катализ.
- •12. Цепные реакции. Озоновый слой. Возникновение и разрушение озонового слоя планеты, влияние примесей на этот процесс.
- •13. Химическое равновесие. Константы равновесия. Смещение равновесий. Принцип Ла-Шателье.
- •14. Общая характеристика растворов. Способы выражения концентрации растворов.
- •15. Растворимость и произведение растворимости.
- •16. Водные растворы электролитов и неэлектролитов. Диссоциация. Сильные и слабые электролиты.
- •17. Равновесия в растворах слабых электролитов. Константа и степень диссоциации.
- •18. Сложные равновесия в растворах. Буферные растворы.
- •19. Водородный показатель (pH). Ионное произведение воды. Определение величины pH в растворах сильных и слабых электролитов.
- •20. Гидролиз солей, примеры.
- •21. Дисперсные системы.
- •22. Окислительно-восстановительные реакции. Понятие восстановительного потенциала.
- •23.Основные классы неорганических соединений и их свойства. Соли: основные, кислые, средние.
- •25. Переходные и непереходные элементы: различие и сходство.
14. Общая характеристика растворов. Способы выражения концентрации растворов.
Раствор – твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Всякий раствор состоит из растворителя, растворенных веществ и продуктов их взаимодействия.
По содержанию растворенных веществ растворы классифицируются на разбавленные (малое содержание растворенного вещества) и концентрированные (высокое). По количеству растворенного вещества относительно предела его растворимости классифицируются на: насыщенные (раствор, находящийся в равновесии с растворяющимся веществом) и ненасыщенные (раствор содержит меньше растворенного вещества, чем его содержит при данной температуре насыщенный).
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями:
Массовая доля (C) – процентное отношение массы растворенного вещества к общей массе раствора.
Мольная доля (Ni) – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе.
Молярная концентрация, или молярность (Cм) – отношение количества растворенного вещества к объему раствора, (моль/л).
Молярная концентрация, или молярность (m) – отношение количества растворенного вещества к массе растворителя, (моль/кг).
Эквивалентная концентрация, или нормальность (Cн или N) – отношение числа эквивалентов растворенного вещества к объему раствора, (моль/л). N к-ты= Cм*(основность к-ты); N основания= Cм*(кислотность основания); N соли= Cм*(основность к-ты)*(число кислотных остатков).
Эквивалент – такое количество вещества, которое взаимодействует (присоединяет, выделяет, замещает) 1 моль атомов водорода.
15. Растворимость и произведение растворимости.
Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Обычно растворимость твердых веществ и жидкостей выражают значением коэффициента растворимости (S), т.е. массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора.
Растворимость газов часто характеризуют коэффициентом абсорбации, который выражает объем газа, растворяющегося в одном объеме растворителя с образованием насыщенного раствора. Закон Генри: масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению газа. Из закона Генри следует, что объем растворяющегося газа (а значит, и коэффициент абсорбации) не зависит при данной температуре от парциального давления газа.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
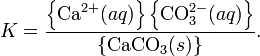
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
