
- •Механика Кинематика криволинейного движения
- •Скорость и ускорение. Нормальное и тангенсальное.
- •Полное ускорение
- •Кривизна траектории.
- •Вращательное движение
- •Радиус вектор
- •Угловая скорость, ускорение
- •Зависимость угла скорости и угла поворота от времени.
- •Поступательное вращательное движение
- •Динамика Законы Ньютона
- •Сила как мера взаимодействия тел.
- •Поле Сил Силовые поля
- •Электростатическое поле (поле неподвижных зарядов)
- •Гравитационное поле
- •Электромагнитное поле, постоянное во времени (поле постоянных токов)
- •Электромагнитное поле (общий случай)
- •Границы применения сил, классификация Прямые и обратные задачи механики. Начальные и граничные условия.
- •Энергия и работа. (теорема о Ек)
- •Потенциальная энергия, как энергия в-я.
- •Системы изолированные и неизолированные.
- •Диссипация энергии в диссипативной системе
- •Работа переменной силы.
- •Работа и энергия в поле тяготения
- •Общие характеристики гравитационного поля.
- •Напряженность и потенциал гравитационного поля.
- •Гравитационный потенциал и уравнения движения
- •Связь потенциальной энергии и силы
- •Потенциальные кривые и энергетические уровни
- •Импульс (II закон Ньютона с использованием импульса).
- •Закон сохранения импульса
- •Вращательное движение
- •Момент силы.
- •Момент импульса.
- •Момент инерции
- •Осевые моменты инерции некоторых тел
- •Теорема Штейнера
- •[Править]Вывод
- •[Править]Пример
- •Основное уравнение динамики вращательного движения
- •Зако́н сохране́ния моме́нта
- •Гироскопический эффект
- •Кинетическая энергия вращающегося тела
- •Работа при вращательном движении
- •Общий случай плоского движения
- •Основное свойство плоского движения.
- •Сравнительный характер поступательного и вращательного движения.
- •Колебательные движения
- •Смещение, скорость, ускорение, фаза, начальная фаза колебательного движения.
- •Энергия незатухающего колебательного движения Гармонический осциллятор
- •Сложение колебаний одного направления и биений
- •Сложение взаимно перпендикулярных колебаний. Фигура Лиссажу.
- •Математический маятник
- •Физический маятник(приведенная длина, точка качения и их св-ва, вывод формулы периода).
- •[Править]Вычисление
- •Затухающие колебания(логарифмический декремент, 4 подхода к определению добротности)
- •Вынужденные колебания
- •Консервативный гармонический осциллятор
- •II закон Ньютона к поступательному, вращательному, колебательному движению.
- •Теория относительности
- •Следствия из постулатов сто
- •1. Относительность одновременности событий
- •2. Относительность промежутков времени
- •3. Относительность расстояний
- •4. Сложение скоростей в сто
- •5. Закон Ньютона в релятивистской форме
- •6. Связь между энергией и массой
- •Молекулярная физика Адиабатический процесс
- •Физический смысл адиабатического процесса
- •Адиабата Пуассона
- •Политропный процесс
- •Теорема Больцмана
- •[Править]h-теорема
- •Молекулярная теплоемкость газа.
- •Теплоёмкость для различных состояний вещества
- •Термодинамика Первое начало термодинамики
- •[Править]Частные случаи
- •Работа газа при изопроцессах
- •Молярная и удельная теплоемкость газа.
- •II начало термодинамики
- •Ограничения
- •Обратимые и необратимые процессы
- •Квазистатический процесс Квазистатический процесс
- •Значение квазистатических процессов
- •Виды квазистатических процессов
- •Тепловые, холодильные машины.(их кпд) Цикл Карно.
- •Кпд тепловой машины Карно
- •Приведенная теплота и теорема Клаузиса
- •Энтропия
- •Изменение энтропии при квазистопическом процессе.
- •Энтропия в изолированной системе
- •Макро и микро состояния.
- •Термодинамическая вероятность состояний
- •Эргодическая гипотеза Статистическое толкование энтропии
- •Теорема Нерста
- •Параметрическая формула и распределение Больцмана
- •Распределение Максвелла Реальные газы
- •Уравнение Ван-дер-Ваальса
- •Уравнение состояния
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Явление переноса
- •Эффективное сечение
- •Число столкновений и средняя длина свободного пробега молекул в газах
Теорема Нерста
Теорема Нернста (тепловая теорема Нернста) - утверждение, являющееся одной из формулировок третьего начала термодинамики, сформулированное Вальтером Нернстом в 1906 году как обобщение экспериментальных данных по термодинамике гальванических элементов.
Теорема
Нернста утверждает, что всякий
термодинамический процесс, протекающий
при фиксированной температуре T в сколь
угодно близкой к нулю, ![]() ,
не должен сопровождаться изменением
энтропии S, то есть изотерма T =
0 совпадает
с предельной адиабатой S0.
,
не должен сопровождаться изменением
энтропии S, то есть изотерма T =
0 совпадает
с предельной адиабатой S0.
Макс
Планк в
1910 году сформулировал более жесткое
утверждение: величина S0 была
конечной и S0 =
0.
В формулировке Планка теорема Нернста
имеет вид начального (граничного или
предельного) условия для системы
дифференциальных уравнений определяющих
энтропию: При выключении температуры, ![]() ,
энтропия термодинамической системы
также стремится к нулю:
,
энтропия термодинамической системы
также стремится к нулю: ![]()
Параметрическая формула и распределение Больцмана
Молекулы любого газа находятся в постоянном потенциальном поле тяготения Земли. Тяготение с одной стороны и тепловое движение молекул с другой с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает. Пологая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова, пусть на высоте h атмосферное давление равно P, тогда на высоте h + dh оно равно P + dP. При dh больше нуля dP должно быть меньше нуля, т.к. давление с высотой убывает.
Разность давлений P и P + dP равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью 1 м2, тогда
P– (P + dP) = ρ⋅g⋅dh,
где ρ– плотность газа на высоте h, а изменение dh настолько мало, что плотность газа можно считать постоянной, тогда
dP = –ρ⋅g⋅dh (1)
Из уравнения Менделеева-Клапейрона
![]()
Подставим в формулу (1), получим

С изменением высоты от h1 до h2 давление меняется от P1 до P2, тогда
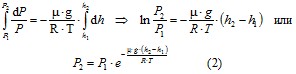
Выражение (2) определяет параметрическую формулу. Если обозначить высоту относительно уровня моря, где давление считается нормальным, тогда выражение (2) можно записать в виде
![]()
При P = n⋅k⋅T
![]()
где n– концентрация молекул на высоте h. Принимая во внимание, что μ = m0⋅NA, R = k⋅NA, получим
![]()
m0⋅g⋅h– это есть потенциальная энергия, тогда
![]()
Выражение (5) определяет распределение Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле.
Распределение Максвелла Реальные газы
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М —молярная масса; R — газовая постоянная.
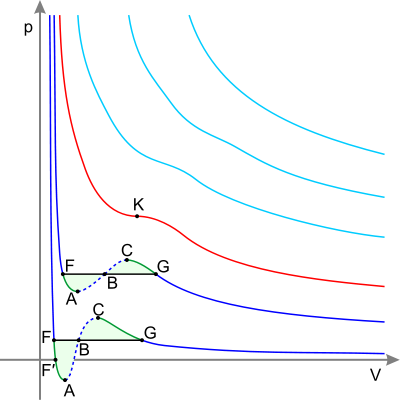
Изотермы реального газа (схематично) Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния. Участок левее точки F — нормальная жидкость. Точка F — точка кипения. Прямая FG — равновесие жидкой и газообразной фазы. Участок FA — перегретая жидкость. Участок F′A — растянутая жидкость (p<0). Участок AC — аналитическое продолжение изотермы, физически невозможен. Участок CG — переохлаждённый пар. Точка G — точка росы. Участок правее точки G — нормальный газ. Площади фигуры FAB и GCB равны. Красная — критическая изотерма. K — критическая точка. Голубые — сверхкритические изотермы
