
- •Механика Кинематика криволинейного движения
- •Скорость и ускорение. Нормальное и тангенсальное.
- •Полное ускорение
- •Кривизна траектории.
- •Вращательное движение
- •Радиус вектор
- •Угловая скорость, ускорение
- •Зависимость угла скорости и угла поворота от времени.
- •Поступательное вращательное движение
- •Динамика Законы Ньютона
- •Сила как мера взаимодействия тел.
- •Поле Сил Силовые поля
- •Электростатическое поле (поле неподвижных зарядов)
- •Гравитационное поле
- •Электромагнитное поле, постоянное во времени (поле постоянных токов)
- •Электромагнитное поле (общий случай)
- •Границы применения сил, классификация Прямые и обратные задачи механики. Начальные и граничные условия.
- •Энергия и работа. (теорема о Ек)
- •Потенциальная энергия, как энергия в-я.
- •Системы изолированные и неизолированные.
- •Диссипация энергии в диссипативной системе
- •Работа переменной силы.
- •Работа и энергия в поле тяготения
- •Общие характеристики гравитационного поля.
- •Напряженность и потенциал гравитационного поля.
- •Гравитационный потенциал и уравнения движения
- •Связь потенциальной энергии и силы
- •Потенциальные кривые и энергетические уровни
- •Импульс (II закон Ньютона с использованием импульса).
- •Закон сохранения импульса
- •Вращательное движение
- •Момент силы.
- •Момент импульса.
- •Момент инерции
- •Осевые моменты инерции некоторых тел
- •Теорема Штейнера
- •[Править]Вывод
- •[Править]Пример
- •Основное уравнение динамики вращательного движения
- •Зако́н сохране́ния моме́нта
- •Гироскопический эффект
- •Кинетическая энергия вращающегося тела
- •Работа при вращательном движении
- •Общий случай плоского движения
- •Основное свойство плоского движения.
- •Сравнительный характер поступательного и вращательного движения.
- •Колебательные движения
- •Смещение, скорость, ускорение, фаза, начальная фаза колебательного движения.
- •Энергия незатухающего колебательного движения Гармонический осциллятор
- •Сложение колебаний одного направления и биений
- •Сложение взаимно перпендикулярных колебаний. Фигура Лиссажу.
- •Математический маятник
- •Физический маятник(приведенная длина, точка качения и их св-ва, вывод формулы периода).
- •[Править]Вычисление
- •Затухающие колебания(логарифмический декремент, 4 подхода к определению добротности)
- •Вынужденные колебания
- •Консервативный гармонический осциллятор
- •II закон Ньютона к поступательному, вращательному, колебательному движению.
- •Теория относительности
- •Следствия из постулатов сто
- •1. Относительность одновременности событий
- •2. Относительность промежутков времени
- •3. Относительность расстояний
- •4. Сложение скоростей в сто
- •5. Закон Ньютона в релятивистской форме
- •6. Связь между энергией и массой
- •Молекулярная физика Адиабатический процесс
- •Физический смысл адиабатического процесса
- •Адиабата Пуассона
- •Политропный процесс
- •Теорема Больцмана
- •[Править]h-теорема
- •Молекулярная теплоемкость газа.
- •Теплоёмкость для различных состояний вещества
- •Термодинамика Первое начало термодинамики
- •[Править]Частные случаи
- •Работа газа при изопроцессах
- •Молярная и удельная теплоемкость газа.
- •II начало термодинамики
- •Ограничения
- •Обратимые и необратимые процессы
- •Квазистатический процесс Квазистатический процесс
- •Значение квазистатических процессов
- •Виды квазистатических процессов
- •Тепловые, холодильные машины.(их кпд) Цикл Карно.
- •Кпд тепловой машины Карно
- •Приведенная теплота и теорема Клаузиса
- •Энтропия
- •Изменение энтропии при квазистопическом процессе.
- •Энтропия в изолированной системе
- •Макро и микро состояния.
- •Термодинамическая вероятность состояний
- •Эргодическая гипотеза Статистическое толкование энтропии
- •Теорема Нерста
- •Параметрическая формула и распределение Больцмана
- •Распределение Максвелла Реальные газы
- •Уравнение Ван-дер-Ваальса
- •Уравнение состояния
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Явление переноса
- •Эффективное сечение
- •Число столкновений и средняя длина свободного пробега молекул в газах
Адиабата Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[5][14][15]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
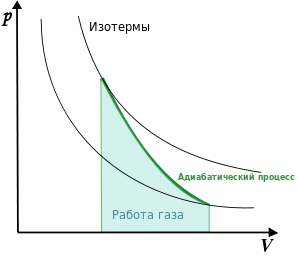
График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
p —
давление газа;
V —
объём.
диаграмме
для газа.
p —
давление газа;
V —
объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где T — абсолютная температура газа. Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении V)
газ нагревается (T возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении V)
газ нагревается (T возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
Политропный процесс
Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где
величина ![]() называется
показателем политропы.
называется
показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
Здесь γ — показатель адиабаты.
4.
Изохорный процесс: ![]() ,
так как
,
так как ![]() ,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1 обратились
в 1, n должна быть бесконечность.
,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1 обратились
в 1, n должна быть бесконечность.
Теорема Больцмана
В термодинамике и кинетической теории, H-теорема, полученная Больцманом в 1872 году, описывает возрастание энтропии идеального газа в необратимых процессах, исходя из уравнения Больцмана.
На первый взгляд может показаться, что она описывает необратимое возрастание энтропии исходя из микроскопических обратимых уравнений динамики. В свое время этот результат вызвал бурные споры.
[Править]h-теорема
Величина H определяется как интеграл по пространству скоростей:
![]()
где P(v) — вероятность.
Используя уравнение Больцмана, можно показать, что H не может возрастать.
Для системы из N статистически независимых частиц, H соотносится с термодинамической энтропией S посредством:
![]()
таким образом, согласно H-теореме, S не может убывать.
Однако Лошмидт выдвинул возражение, что невозможно вывести необратимый процесс из симметричных во времени уравнений динамики. Решение парадокса Лошмидта заключается в том, что уравнение Больцмана основано на предположении «молекулярного хаоса», то есть для описания системы достаточно одночастичной функции распределения. Это допущение по сути и нарушает симметрию во времени.
Распределение энергии по степеням свободы:
Молекулы можно рассматривать как системы материальных точек (атомов) совершающих как поступательное, так и вращательное движения. При исследовании движения тела необходимо знать его положение относительно выбранной системы координат. Для этого вводится понятие о степенях свободы тела. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела.
При движении точки по прямой линии для оценки ее положения необходимо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движения по плоскости, ее положение характеризуется двумя координатами; при этом точка обладает двумя степенями свободы. Положение точки в пространстве определяется 3 координатами. Число степеней свободы обычно обозначают буквой i. Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий).
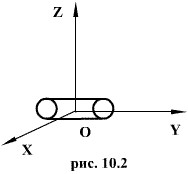
Двухатомные жесткие молекулы, например молекулы водорода, азота и др., обладают пятью степенями свободы: они имеют 3 степени свободы поступательного движения и 2 степени свободы вращения вокруг осей ОХ и OZ. Вращением вокруг оси OY можно пренебречь, т.к. момент инерции ее относительно этой оси пренебрежимо мал. Поэтому вклад энергии вращательного движения вокруг оси OY в суммарную энергию двухатомной молекулы можно не учитывать.
Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой, имеют число степеней свободы i = 6: три степени свободы поступательного движения и 3 степени свободы вращения вокруг осей ОХ, OY и OZ.
В этом случае, если расстояние между атомами может изменяться (нежесткие молекулы), появляются дополнительные степени свободы .
Согласно
молекулярно-кинетической теории газов
движение молекул носит беспорядочный
характер; эта беспорядочность относится
ко всем видам движения молекулы. Ни один
из видов движения не имеет преимущества
перед другим. При статистическом
равновесии движений энергия в среднем
распределяется равномерно между всеми
видами движения. Закон равномерного
распределения энергии по степеням
свободы молекул можно сформулировать
следующим образом: статистически в
среднем на каждую степень свободы
молекул приходится одинаковая энергия.
Поступательное движение молекул
характеризуется средней кинетической
энергией, равной ![]() .
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
.
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
![]()
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной
|
