
Термодинамика
Динамический метод основан на законах Ньютона,под состоянием частицы определяется знание ее координат и импульсов
Термодинамический метод возник в след за динамическим. Вообще говоря, в любой системе можно рассмотреть или заметить те состояния,которые связаны с микросостояниями.
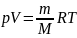
Связывает параметры уравнения состояния,макропараметры
Если число частиц в системе достаточно весомо,то термодинамический метод применить нельзя.
Статистический метод -этот метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т. д.). Например, температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени разные молекулы имеют различные скорости, то она может быть выражена только через среднее значение скорости движения молекул. Нельзя говорить о температуре одной молекулы. Таким образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул.
Параметры состояния – свойства системы, выбранные в качестве независимых переменных.
Функция состояния – величина, определяемая этими параметрами, однозначно характеризует систему и не зависит от пути ее перехода из одного состояния в другое. (если для 1 моля идеального газа параметрами состояния выбрать давление и температуру, то функцию состояния объем можно рассчитать по ура нению состояния Менделеева-Клапейрона РV=RТ).
Способ распределения частиц по ячейкам без учета их номеров называется макросостоянием системы.
(В рассматриваемом примере возможны всего пять разных макросостояний . 1 – все четыре частицы находятся в левой ячейке, 2 – три частицы в левой ячейке и одна в правой, 3 – две частицы в левой ячейке и две в правой. Ещё два макросостояния симметричны первому и второму.)
Способ распределения частиц по ячейкам с учетом их номеров называется микросостоянием системы.
Число микросостояний, соответствующих какому-либо макросостоянию системы, называется термодинамической вероятностью(статистическим весом) этого макросостояния. Термодинамическая вероятность любого макросостояния системы не зависит от предшествующих и будущих состояний. Изменение термодинамической вероятности при переходе от одного макросостояния к другому не зависит от пути перехода, а зависит только от начального и конечного макросостояний. При циклическом процессе термодинамическая вероятность возвращается к исходному значению.
Энтропия
в статистической физике Приведенное
количество теплоты, которое сообщается
телу на малом участке процесса, равно
δQ/T. Приведенное количество теплоты,
которое сообщается телу в любом обратимом
круговом процессе, равно нулю:
![]() (1)
Из
равенства нулю интеграла (1), взятого по
замкнутому контуру, следует, что
подынтегральное выражение δQ/T есть
полный дифференциал некоторой функции,
которая определяется только состоянием
системы и не зависит от пути, которым
система пришла в это состояние. Таким
образом,
(1)
Из
равенства нулю интеграла (1), взятого по
замкнутому контуру, следует, что
подынтегральное выражение δQ/T есть
полный дифференциал некоторой функции,
которая определяется только состоянием
системы и не зависит от пути, которым
система пришла в это состояние. Таким
образом,
![]() (2)
Функция
состояния, у которой дифференциал равен
δQ/T, называется энтропией и
обозначается S.
Из
формулы (1) следует, что для обратимых
процессов изменение энтропии
(2)
Функция
состояния, у которой дифференциал равен
δQ/T, называется энтропией и
обозначается S.
Из
формулы (1) следует, что для обратимых
процессов изменение энтропии
![]() (3)
В
термодинамике доказывается, что энтропия
системы, совершающей необратимый цикл,
возрастает:
(3)
В
термодинамике доказывается, что энтропия
системы, совершающей необратимый цикл,
возрастает:
![]() (4)
Выражения
(3) и (4) применяются только к замкнутым
системам, если же система обменивается
теплотой с внешней средой, то ее энтропия
может вести себя произвольным образом.
Соотношения (3) и (4) можно представить в
виде неравенства
Клаузиуса
(4)
Выражения
(3) и (4) применяются только к замкнутым
системам, если же система обменивается
теплотой с внешней средой, то ее энтропия
может вести себя произвольным образом.
Соотношения (3) и (4) можно представить в
виде неравенства
Клаузиуса
![]() (5)
т.
е. энтропия
замкнутой системы может либо возрастать (в
случае необратимых процессов), либо
оставаться постоянной (в
случае обратимых процессов).
(5)
т.
е. энтропия
замкнутой системы может либо возрастать (в
случае необратимых процессов), либо
оставаться постоянной (в
случае обратимых процессов).
Вопрос 2
Первое начало термодинамики : количество теплоты Q, сообщенное системе, расходуется на увеличение ее внутренней энергии dU и на совершение работы А системой, т.е. Q = dU + А
Уравнение состояния идеального газа
Т=const
Работа
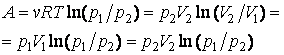
Внутренняя энергия
![]()
Теплоемкость
Количество теплоты, котоpое нужно сообщить телу, чтобы повысить его темпеpатуpу на 1 К, называется теплоемкостью тела
В
изотермическом процессе постоянна
температура, то есть ![]() .
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности:
.
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности: ![]()
Вопрос 3
V=const
Работа A=0
Внутренняя энергия
![]()
![]()
где ![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Темлоемксоть
![]()
где i — число степеней свободы частиц газа.
Вопрос 4
P=const
Работа A = p(V2 – V1) = pΔV.,площадь фигуры под графиком
Внутренняя энергия
Теплоемкость CP=δQ/νΔT=CV+R=((i+2)/2)*R
Вопрос 5
Изобарная теплоемкость
![]()
Изохорная теплоемкость
![]()
Уравнение Майера
![]() ,
,
где ![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная, ![]() —
молярная теплоёмкость при
постоянном давлении,
—
молярная теплоёмкость при
постоянном давлении, ![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Уравнение Майера вытекает из первого начала термодинамики, примененного к изобарическому процессу в идеальном газе:
![]() ,
,
в рассматриваемом случае:
![]()
![]() .
.
Очевидно, уравнение Майера показывает, что различие теплоёмкостей газа равно работе, совершаемой одним молем идеального газа при изменении его температуры на 1 K, и разъясняет смысл универсальной газовой постоянной R — механический эквивалент теплоты.
Вопрос 6
Адиабатны процесс
Q=0,система не получает тепло
![]()

![]()
![]()
![]()
Теплоемкоcть
![]()
Уравнение Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, адиабата имеет простейший вид и определяется уравнением
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
и
— показатель
адиабаты,
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где T — абсолютная температура газа. Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении V)
газ нагревается (T возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении V)
газ нагревается (T возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
Вопрос 7
Политропный процесс проходит при постоянной теплоемкости
С=0
pVn = const уравнение политропы
![]() называется
показателем политропы.
называется
показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
Здесь γ — показатель адиабаты.
4.
Изохорный процесс: ![]() ,
так как
,
так как ![]() ,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1 обратились
в 1, n должна быть бесконечность.
,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1 обратились
в 1, n должна быть бесконечность.
Работа политропного процесса
A=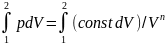
Процессы с отрицательной теплоемкостью
Однако теплоемкость может быть и отрицательной .
1) при получении тепла система охлаждается ,
2) при отдаче тепла система разогревается .
Оба случая легко объясняются при помощи первого закона термодинамики , записанного в следующем виде:
|
|
(4.4.18) |
В
первом случае газ производит работу
расширения ![]() в
количестве большем, чем количество
теплоты
в
количестве большем, чем количество
теплоты ![]() ,
которое подводится к газу в процессе
расширения
,
которое подводится к газу в процессе
расширения ![]() .
В этом случае на производство работы
помимо тепла, подведенного к газу,
расходуется и некоторое количество его
внутренней энергии. Хотя к газу и
подводится тепло, но оно целиком
превращается в работу, а убыль внутренней
энергии
.
В этом случае на производство работы
помимо тепла, подведенного к газу,
расходуется и некоторое количество его
внутренней энергии. Хотя к газу и
подводится тепло, но оно целиком
превращается в работу, а убыль внутренней
энергии ![]() газа
ведет к снижению температуры.
газа
ведет к снижению температуры.
Во
втором случае работа, производимая над
газом при его сжатии ![]() ,
оказывается по абсолютной величине
большей, чем количество отдаваемого им
тепла . С учетом знаков количества
теплоты
,
оказывается по абсолютной величине
большей, чем количество отдаваемого им
тепла . С учетом знаков количества
теплоты ![]() и
работы
и
работы ![]() равенство
(4.4.19) принимает вид:
равенство
(4.4.19) принимает вид:
|
|
(4.4.19) |
Внутренняя энергия системы увеличивается , а значит, ее температура растет, несмотря на то, что газ отдает теплоту. Подобный процесс происходит в некоторых звездах: гравитационные силы при сжатии звезды совершают работу большую, чем излучаемое ей тепло, поэтому звезда разогревается, несмотря на то, что она излучает теплоту.
