
- •Лекція №14. Поверхневі явища. Адсорбція на межі поділу рухомих фаз
- •За здатністю молекул пар до іонізації їх поділяють на класи:
- •Іоногенні колоїдні пар:
- •Лекція №15. Адсорбція на твердому адсорбенті
- •Теорія мономолекулярної адсорбції (Ленгмюр, 1915):
- •Адсорбція на межі тверде тіло ‑ розчин
- •Лекція №16. Застосування адсорбції
- •Застосування адсорбції
- •Лекція №16. Дисперсні системи. Колоїдні розчини. Методи добування та очищення
- •Грубодисперсні системи
- •Загальна характеристика
- •Очищення колоїдних розчинів
- •Лекція №17. Будова колоїдних частинок. Стійкість колоїдних розчинів. Коагуляція
- •Механізми утворення пеш
- •Стійкість колоїдних розчинів
- •Між колоїдними частинками діють дві взаємно протилежні сили:
- •Стійкість дисперсної системи
- •У цукровій промисловості при очищенні соку цукрового буряка (дифузійний сік)
- •Лекція №18. Властивості колоїдних розчинів
- •Рівняння Релея (теорія світлорозсіювання для сферичних непоглинаючих світло частинок, 1871р.)
- •Визначення концентрації спирту в розчині
- •Конденсаційні методи.
- •Диспергаційні методи.
- •Тип емульсії визначають:
- •Методи одержання емульсій
- •Емульгування ‑ одержання емульсій шляхом диспергування однієї рідини в іншій струшуванням, інтенсивним перемішуванням. Емульгуванню сприяють:
- •Високомолекулярні сполуки класифікують:
- •І За походженням
- •Іі. За формою макромолекул
- •Склоподібний стан
- •Кристалічний стан
- •В’язко-текучий стан
- •Залежність властивостей некристалічних полімерів від температури
- •Властивості полімерів:
- •Властивості розчинів вмс:
- •Властивості розчинів вмс:
- •Властивості розчинів вмс
- •Кількісні характеристики процесу набухання
- •Тиск набухання
- •Ступінь набухання (α)
- •Форми існування води у полімерах
- •Лекція №21. Високомолекулярні сполуки – важлива складова частина продуктів харчування
- •Зміна колагену при тепловій обробці
- •Основні зміни, що відбуваються з білками при їх нагріванні
- •Зміни вуглеводів у технологічних процесах
- •Способи уповільнення реакції меланоїдиноутворення:
- •Зміни кольору та формування смако-ароматичного комплексу при тепловій обробці продуктів
- •Роль білків і крохмалю у хлібопекарському виробництві
- •Речовини, які змінюють структуру і фізико-хімічні властивості харчових продуктів
Лекція №17. Будова колоїдних частинок. Стійкість колоїдних розчинів. Коагуляція
Основні питання:
Будова колоїдних частинок.
Електрокінетичні явища. Подвійний електричний шар.
Агрегативна та седиментаційна стійкість колоїдних систем.
Коагуляція. Фактори, що спричиняють коагуляцію. Колоїдний захист.
Структурна колоїдна частинка дисперсної фази – міцела.
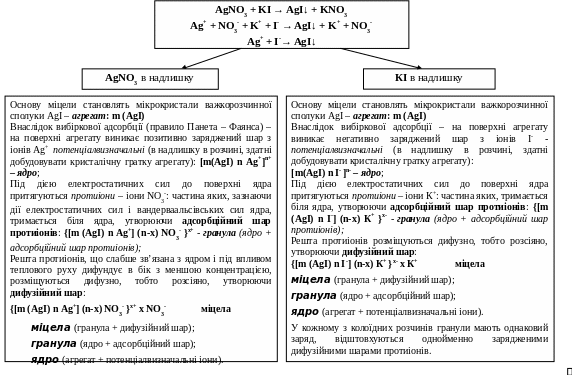
При змішуванні розведених розчинів AgNO3 та КІ за умови, що один з реагентів узятий в надлишку, йодид срібла не випадає в осад, а утворює колоїдний розчин.
Міцела – електронейтральна частинка. Складається з гранули та дифузійного шару протиіонів. Гранула складається з агрегату, ядра, адсорбційного шару проти іонів. Заряд гранули визначається за знаком заряду потенціалвизначальних іонів.
Межу між гранулою та дифузійним шаром називають межею, або поверхнею ковзання. Межа ковзання вказує на геометричну поверхню по якій відбувається розділення міцели при її переміщенні відносно дисперсійного середовища.
На поверхні кристалу виникає подвійний електричний шар (ПЕШ), який складається з потенціалвизначальних іонів і протиіонів, що розташовані в адсорбційному шарі в кількості (n-x) , а в дифузійному – х-іонів.
Система просторового розділення зарядів на межі розділу фаз – подвійний електричний шар (ПЕШ).
ПЕШ – єдина електронейтральна система: сумарна кількість зарядів протиіонів дорівнює заряду твердої поверхні (внутрішня обкладка). Зовнішня обкладка ПЕШ (шар протиіонів) складається з: щільної й дифузійної.
Механізми утворення пеш



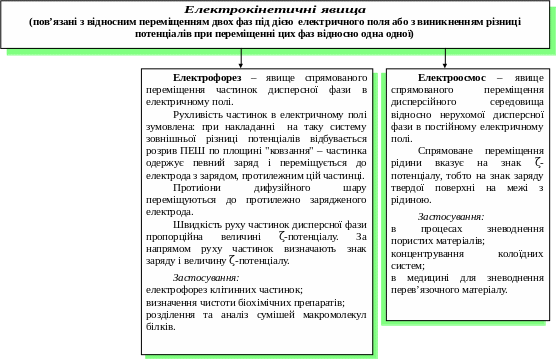
Принцип методів електрофоретичного розділення полягає у здатності молекул пептидів і амінокислот, знаходячись в зарядженій формі у вигляді катіонів або аніонів, рухатися в електричному полі з певною швидкістю. Крім того, молекули з близькими зарядами, але різними розмірами, відрізняються співвідношенням заряду до маси.
Вперше метод електрофорезу був розроблений Тізеліусом із застосуванням паперу в якості носія і спеціальних оптичних приладів, що реєструють зміщення границі розчину білка і розчинника за показниками заломлення (фронтальний електрофорез). Сьогодні широко поширені методи зонального електрофорезу з використанням крохмальних і поліакриламідних гелів (ПААГ). Для електрофоретичного розділення білків і пептидів застосовується двомірний електрофорез в ПААГ. Відповідно до цього методу суміш компонентів розділяють спочатку в стовпчику гелю електрофорезом в горизонтальному напрямі, потім в гелевых пластинах – у вертикальному. При розділенні білків гороху вдалося одержати більше 150 різних компонентів.
Стійкість колоїдних розчинів
Стійкість дисперсної системи – це здатність її протягом певного часу зберігати незмінними склад і основні властивості (дисперсність, концентрацію, розподіл частинок дисперсної фази у певному об’ємі дисперсійного середовища та характер взаємодії між частинками).
Між колоїдними частинками діють дві взаємно протилежні сили:
сили притягання (відбувається злипання частинок, які перебувають у броунівському русі);
сили відштовхування (обумовлені електричною взаємодією між іонами подвійних електричних шарів, що оточують кожну колоїдну частинку, перешкоджають зближенню частинок, їх об'єднанню).
Якщо Fпритягання > Fвідштовхування - переважають сили притягання – відбувається коагуляція колоїдного розчину;
Якщо Fпритягання < Fвідштовхування – переважають сили відштовхування ‑ система набуває більшої стійкості.
Характерна особливість колоїдних розчинів – самочинна зміна розміру частинок протягом часу, що спричиняє:
зменшення розмірів частинок – дисолюція (неповне розчинення частинок дисперсної фази при збереженні їх загальної кількості). Це призводить до зменшення питомої поверхні дисперсної фази і зниження запасу вільної поверхневої енергії. Кінетична стійкість золю при цьому підвищується.
укрупнення частинок – перекристалізація, що супроводжується зменшенням їх кількості. При цьому зникають дрібні частинки і збільшуються більш крупні. Це явище характерне для полідисперсних систем, зважені часточки яких здатні розчинятися у дисперсійному середовищі.
При виробництві харчової продукції кристалізацію використовують для очищення цукру, солі, лимонної кислоти. Якщо в результаті перекристалізації необхідно одержати крупні кристали, то кристали відокремлюють від маточного розчину. Дрібні кристали – розміром не більше 10мкм – отримують при виробництві згущеного молока з цукром; при більших розмірах кристалів продукт матиме пісчанисту консистенцію. Дрібні кристали необхідно одержувати при виготовленні помадки з цукрового сиропу, яку часто виготовляють в підприємствах харчування.
