
- •Раздел шестой химическая кинетика
- •6.1. Основные понятия кинетики:
- •6.2. Кинетика простых (односторонних) реакций Необратимые реакции нулевого, 1-го, 2-го и 3-его порядков.
- •6.3. Методы определения порядка реакции.
- •6.4. Влияние температуры на скорость химической реакции
- •6.5. Кинетика сложных реакций
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Сопряженные реакции
- •6.5.1. Приближенные методы химической кинетики
- •6.6.Теоретические представления о механизме химических реакций.
- •Теория активных соударений.
- •Теория активированного комплекса (переходного состояния)
- •6.7.Катализ
- •Гомогенный катализ
- •Ферментативный катализ
Ферментативный катализ
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами биологического происхождения. Это белковые молекулы, называемые ферментами или энзимами. Этот тип катализаторов играет исключительно важную роль при обмене веществ в организме (от одноклеточных до высших растений и животных), незаменимы они и в пищевой промышленности: все процессы брожения являются ферментативными реакциями. Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ.
Ферменты обладают высокой специфичностью и эффективностью действия. По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента. Биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
Задачи разрушения и создания различных клеточных структур обычно реализуются совокупностью ферментов, вызывающих разложение, перенос атомов или групп, перестройку молекул и разнообразные процессы окисления. По характеру катализируемых реакций ферменты разделяются на три большие группы
Гидролазы – ферменты, катализирующие гидролиз – расщепляют пептидные связи в белках и пептидах
Ферменты, переносящие в биологических объектах различные группы атомов, а также водород. Разнообразие продуктов синтеза связано с функциями ферментов этой группы.
Ферменты, катализирующие многие реакции в процессе обмена веществ, например: в реакциях перестройки молекулы в которых не изменяется количественный состав молекулы, но возникают новые функциональные группы; в реакциях с разрывом связей между атомами углерода.
В настоящее время известно более двух тысяч ферментов, причем около 150 ферментов выделено в кристаллической форме.
Субстрат – это химическое вещество, скорость превращения которого в продукт регулируется ферментом.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (Е) с реагирующим веществом (субстратом S) и разрушение этого комплекса с образованием продуктов реакции (Р):
![]() .
.
Это типичный пример последовательной реакции. Применение к ней метода стационарных концентраций Боденштейна (при условии, что k3>>k1) с учетом уравнения материального баланса [E]=[E0]-[ES] (индекс «0» означает начальную концентрацию) дает уравнение Михаэлиса-Ментен, в котором скорость образования продукта выражена через начальную концентрацию фермента и текущую концентрацию субстрата:
![]() ,
,
где wmax=k2[E0] – максимальная скорость реакции (при бесконечно большой концентрации субстрата);
![]() - это константа Михаэлиса. Она равна
концентрации субстрата, при которой
скорость реакции равна половине
максимальной скорости. Константа
Михаэлиса характеризует специфичность
фермента по отношению к субстрату (чем
меньше, тем специфичнее) Типичные
значения KM
от 10-6 до 10-1 моль/л. Константу
скорости k3 иногда
называют числом оборотов фермента.
Она равна числу молекул субстрата,
которые превращаются на активном центре
фермента в единицу времени. Предел ее
колебаний составляет от 10 до 108
мин-1.
- это константа Михаэлиса. Она равна
концентрации субстрата, при которой
скорость реакции равна половине
максимальной скорости. Константа
Михаэлиса характеризует специфичность
фермента по отношению к субстрату (чем
меньше, тем специфичнее) Типичные
значения KM
от 10-6 до 10-1 моль/л. Константу
скорости k3 иногда
называют числом оборотов фермента.
Она равна числу молекул субстрата,
которые превращаются на активном центре
фермента в единицу времени. Предел ее
колебаний составляет от 10 до 108
мин-1.
Уравнение Михаэлса можно записать в линейных координатах:
![]() .
.
Для определения параметров уравнения KM и wmax проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 – 1/[S0].
Иногда течение ферментативной реакции осложняется присутствием ингибиторов – веществ, способных образовывать комплексы с ферментом или фермент-субстратным комплексом. Различают конкурентное, неконкурентное и смешанное ингибирование.
При конкурентном механизме ингибитор (I) конкурирует с субстратом за активные участки фермента. Простейшая кинетическая схема данного процесса имеет вид:
![]() ,
,
![]() .
.
Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексу EI с учетом уравнений материального баланса
![]()
и
![]()
дает для скорости реакции следующее уравнение
 ,
,
где эффективная константа Михаэлиса связана с исходной концентрацией ингибитора:
![]() .
.
Величин
![]() представляет собой константу диссоциации
комплекса фермента с ингибитором и
называется константой ингибирования.
Таким образом, при конкурентном
ингибировании увеличивается константа
Михаэлиса, а максимальная скорость
ферментативной реакции остается
неизменной.
представляет собой константу диссоциации
комплекса фермента с ингибитором и
называется константой ингибирования.
Таким образом, при конкурентном
ингибировании увеличивается константа
Михаэлиса, а максимальная скорость
ферментативной реакции остается
неизменной.
При неконкурентом механизме ингибитор обратимо связывает как фермент, так и промежуточный комплекс фермента с субстратом. Простейшая кинетическая схема данного процесса имеет вид:
![]()
![]() .
.
Предполагается, что константы диссоциации комплексов EI и ESI одинаковы. Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексам EI и ESI с учетом уравнений материального баланса
![]()
и
дает для скорости реакции следующее уравнение
![]() ,
,
где эффективная максимальная скорость связана с начальной концентрацией ингибитора выражением:
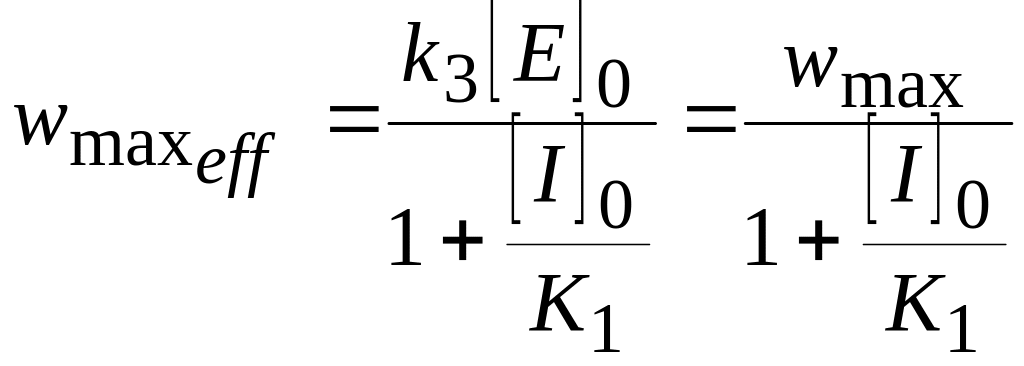 .
.
При неконкурентном ингибировании максимальная скорость реакции уменьшается, а константа Михаэлиса остается неизменной.
Смешанное ингибирование описывается более сложными кинетическими схемами. При смешанном ингибировании изменяются и константа Михаэлиса, и максимальная скорость ферментативной реакции.
Контрольные вопросы
Что называется скоростью химической реакции? Напишите выражения для средней и истинной скорости. Как она определяется?
Как связана скорость реакции 3H2 + N2 = 2NH3, выраженная по водороду, со скоростями этой реакции, выраженными по другим компонентам?
Как различается общая скорость реакции от скорости данной реакции по одному из реагентов?
Сформулируйте и запишите основной постулат химической кинетики в общем виде и для реакции 2NO + O2 = 2NO2.
Укажите физический смысл константы скорости химической реакции.
Что называется молекулярностью химической реакции? В каких случаях могут совпадать численные значения порядка и молекулярности? Приведите примеры моно-, би- и тримолекулярных реакций. Может ли быть молекулярность реакции больше трех?
Что называется порядком химической реакции? Как связан общий порядок реакции с частными порядками по отдельным компонентам? Может ли порядок реакции быть дробным или отрицательным?
Какие реакции называются простыми и сложными? Что называется механизмом реакции?
Запишите кинетические уравнения для реакций нулевого и первого порядков в дифференциальной и интегральной формах. Как в этих случаях изменяется концентрация реагирующих веществ во времени? Изобразите эти зависимости графически в линейных координатах. Какова размерность константы скорости этих реакций?
Запишите в дифференциальной и интегральной формах кинетические уравнения для реакций второго и третьего порядков при условии, что исходные концентрации реагирующих веществ равны между собой. Изобразите эти зависимости графически в линейных координатах. Какова размерность константы скорости этих реакций.
Что такое время полупревращения (период полураспада)? Как зависит от исходной концентрации период полураспада для реакций первого, второго, третьего и n-го порядков?
Перечислите методы определения порядка реакции и рассмотрите сущность каждого из них.
Как скорость химической реакции зависит от температуры? Сформулируйте правило Вант-Гоффа.
Запишите уравнение Аррениуса в дифференциальной и интегральной формах. Что такое энергия активации? Приведите график, иллюстрирующий понятие энергии активации. Какой вид имеет график зависимости логарифма константы скорости от обратной температуры
Какие реакции в химической кинетике называются сложными? Перечислите и охарактеризуйте их. Какие принципы лежат в основе рассмотрения сложных химических реакций?.
Какие предположения легли в основу теории активных соударений? Основные достоинства и недостатки теории активных соударений.
В чем заключается физическая сущность теории активированного комплекса (переходного состояния)? На каких постулатах основана эта теория?
Катализ. Влияние катализатора на скорость химической реакции. Основные положения гетерогенного катализа. Гомогенный катализ. Ферментативный катализ.
Практическая работа № 1
Определение констант скорости химической реакции методом титрования реакционной смеси
Реакция гидролиза сложного эфира щелочью
Цель работы: Проверить подчиняемость реакции омыления уксусно-этилового эфира щелочью кинетическому уравнению второго порядка.
Реакция гидролиза сложного эфира щелочью
![]()
является гомогенно-гомофазной. Ее скорость определяется концентрациями эфира и щелочи, поэтому реакция описывается кинетическим уравнением второго порядка
![]()
где a - исходное число молей щелочи в пробе,
в - исходное число молей эфира в пробе,
x – число молей эфира или щелочи, вступивших в реакцию
в момент времени t.
Пусть
![]()
![]() и
и
![]() - соответственно объемы кислоты (мл),
пошедшей на титрование щелочи в пробе
объемом V
до начала реакции, в момент времени t
и по окончании реакции, N
– нормальность кислоты. Тогда исходное
число молей щелочи в пробе будет равно
а =
- соответственно объемы кислоты (мл),
пошедшей на титрование щелочи в пробе
объемом V
до начала реакции, в момент времени t
и по окончании реакции, N
– нормальность кислоты. Тогда исходное
число молей щелочи в пробе будет равно
а =
![]() .
Если щелочь взята в избытке, как в нашем
случае, то количество этилацетата,
подвергшегося омылению, т.е. величина
в, будет определяться как разность
между исходным и конечным количеством
щелочи в пробе
.
Если щелочь взята в избытке, как в нашем
случае, то количество этилацетата,
подвергшегося омылению, т.е. величина
в, будет определяться как разность
между исходным и конечным количеством
щелочи в пробе
![]() ,
,
так как по стехиометрическому уравнению на омыление 1 моля эфира расходуется 1 моль щелочи.
Следовательно, к моменту времени t мы получим следующие количества реагирующих веществ:
число
молей щелочи в пробе (а – х)
=
![]() ,
,
число молей эфира или щелочи, вступивших в реакцию
х
=
![]() ,
,
число молей эфира в пробе
![]()
После подстановки этих выражений в уравнение для константы скорости получим уравнение:
![]() ,
,
или в линейной форме, удобной для графической обработки:
![]()
![]() = ln
= ln![]() ,
,
![]()
где
![]() и
и
![]() .
.
Порядок выполнения работы
Вымыть три колбочки для титрования, налить в них примерно по 10 мл дистиллированной воды и поставить в холодильник.
Для приготовления реакционной смеси вымыть мерную колбу на 100 мл и колбочку с широким горлом объемом 250 мл. В мерную колбочку налить 100 мл водного раствора эфира* и перелить его во вторую колбочку. Мерную колбу сполоснуть водой и налить в нее 100 мл раствора едкого натра с концентрацией 1/30 Н. Колбочки закрыть пробками, подвесить к ним груз и поместить в термостат. Через 10-15 минут раствор щелочи вылить в эфир, не вынимая последний из термостата. Момент сливания растворов принять за время начала реакции. За ходом реакции наблюдают в течение полутора часов, последовательно отбирая пробы объемом 10 мл.
Так как изучаемая реакция протекает с заметной скоростью, для прекращения ее в отобранной пробе реакционную смесь выливают в колбочку с охлажденной водой. Щелочь, не успевшую прореагировать к моменту отбора пробы, оттитровывают 1/30 Н раствором кислоты. После титрования освободившуюся колбочку вымыть, налить в нее воду и вновь поставить в холодильник.
Для определения
![]() оттитровывают пробу исходной щелочи
(1/30N) объемом 5 мл, т.к. в 10
мл исходной реакционной смеси содержится
по 5 мл эфира и щелочи. Титрование проводят
не менее трех раз до получения сходимых
результатов.
оттитровывают пробу исходной щелочи
(1/30N) объемом 5 мл, т.к. в 10
мл исходной реакционной смеси содержится
по 5 мл эфира и щелочи. Титрование проводят
не менее трех раз до получения сходимых
результатов.
* Сначала 1,65 мл эфира разбавляют до 100 мл спиртом, а затем 10 мл спиртового раствора разбавляют до 100 мл водой.
Для изучения кинетики реакции гидролиза пробы реакционной смеси отбирают через 2,5,10,20,30,40,50,60,70,80,90 минут, считая от начала реакции.
Реакция омыления
сложного эфира щелочью при комнатной
температуре практически заканчивается
через 10-12 часов. Для ускорения реакции
отдельную пробу реакционной смеси
(35мл) нагревают на водяной бане с обратным
холодильником при температуре 50-60![]() С
в течение часа. После этого смесь
охлаждают и титруют не менее трех раз,
как было описано выше.
С
в течение часа. После этого смесь
охлаждают и титруют не менее трех раз,
как было описано выше.
Следует помнить, что разбавленный раствор щелочи энергично поглощает из воздуха углекислый газ. Поэтому реакционную смесь нужно держать в колбе, плотно закрытой пробкой, и открывать только на время отбора пробы.
Обработка экспериментальных результатов
1. Полученные
экспериментальные значения
![]() и
и
![]() и результаты расчетов занести в таблицу.
По ним построить кинетическую кривую
в координатах
и результаты расчетов занести в таблицу.
По ним построить кинетическую кривую
в координатах
![]() и
и
![]()
Температура
![]()
![]()
t, мин. |
мл |
|
|
|
мин. |
2 |
|
||||
5 |
|||||
10 |
|||||
20 |
|||||
… |
|||||
|
|||||
