
- •Волновая функция
- •Квантово-механическая модель атома
- •Периодические свойства химических элементов
- •Основные оксиды
- •[Править]Кислотные оксиды
- •]Амфотерные оксиды
- •[Править]Получение
- •Кислоты
- •Классификация
- •Получение
- •Химические свойства
- •Основания
- •Получение
- •Химические свойства
- •Классификация
- •Средние соли Получение
- •Химические свойства
- •Получение
- •Химические свойства.
- •[Править] Примеры
- •Количество энтальпии
- •13 Второй закон термодинамики. Энтропия.Энергия Гиббса как критерий вероятности самопроизвольного протекания процесса.
- •Принцип Ле Шателье
- •Донорно-акцепторная связь
- •Метод валентных связей
- •Молекулярность и порядок реакции
- •Температурный коэффициент скорости реакции
Температурный коэффициент скорости реакции
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции , числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10°С. Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций находится в пределах от 2... 4.
Температурный коэффициент определяют в соответствии с так называемым «правилом Вант-Гоффа», которое математически выражается уравнением
v2/v1 = (T2 – T1)/10,
где v1 и v2 – скорости реакции при температурах Т1 и Т2; температурный коэффициент реакции.
Так, например, если = 2, то при Т2 – Т1 = 50°С v2/v1 = 25 = 32, т.е. реакция ускорилась в 32 раза, причем это ускорение никак не зависит от абсолютных величин Т1 и Т2, а только от их разности.
Энергия активации, разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе. Для различных химических реакций Э. а. изменяется в широких пределах — от нескольких до ~ 10 дж./ моль. Для одной и той же химической реакции значение Э. а. зависит от вида функций распределения молекул по энергиям их поступательного движения и внутренним степеням свободы (электронным, колебательным, вращательным). Как статистическую величину Э. а. следует отличать от пороговой энергии, или энергетического барьера, — минимальной энергии, которой должна обладать одна пара сталкивающихся частиц для протекания данной элементарной реакции.
Аррениуса уравнение, температурная зависимость константы скорости к элементарной хим. реакции:
![]()
где A-предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа -энергия активации, обычно принимающая положит. значения, Т-абс. температура, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу. а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в уравнении Аррениуса величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график) – прямая линия, отрицательный наклон которой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
22
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции:
выражение для скорости будет выглядеть так:
.
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз)[источник?] повторяется.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
23
Диспе́рсная систе́ма — это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
-
Дисперсная фаза
Дисперсионная среда
Название и пример
Газообразная
Газообразная
Дисперсная система не образуется
Жидкая
Газообразная
Аэрозоли: туманы, облака
Твёрдая
Газообразная
Аэрозоли (пыли, дымы), порошки
Газообразная
Жидкая
Газовые эмульсии и пены
Жидкая
Жидкая
Эмульсии: нефть, крем, молоко
Твёрдая
Жидкая
Суспензии и золи: пульпа, ил, взвесь, паста
Газообразная
Твёрдая
Пористые тела
Жидкая
Твёрдая
Капиллярные системы: жидкость в пористых телах, грунт, почва
Твёрдая
Твёрдая
Твёрдые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы
Коллоидные растворы. Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 1 до 500 нм. Легко показать, что суммарная поверхность этих частиц огромна. Если предположить, что частицы имеют форму шара с диаметром 10 нм, то при общем объеме этих частиц 1 см3 они будут иметь
площадь поверхности порядка 10 м2. Как указывалось ранее поверхностный слой характеризуется поверхностной энергией и способностью адсорбировать те или иные частицы, в том числе ионы
из раствора. Характерной особенностью коллоидных частиц является наличие на их поверхности заряда, обусловленного избирательной адсорбцией ионов. Коллоидная частица имеет сложное строение. Она включает в себя ядро, адсорбированные ионы, противоины и растворитель. Существуют лиофильные (гид.
роф ильные) коллоиды, в которых растворитель взаимодейстиует с ядрами частиц, илнофобные (гидрофобные) коллоиды, в которых растворитель не взаимодействует с ядрами
частиц. Растворитель входит в состав гидрофобных частиц лишь как сольватная оболочка адсорбированных ионов или при наличии стабилизаторов (ПАВ), имеющих лиофобную и лиофильные части.
Приведем несколько примеров коллоидных частиц:
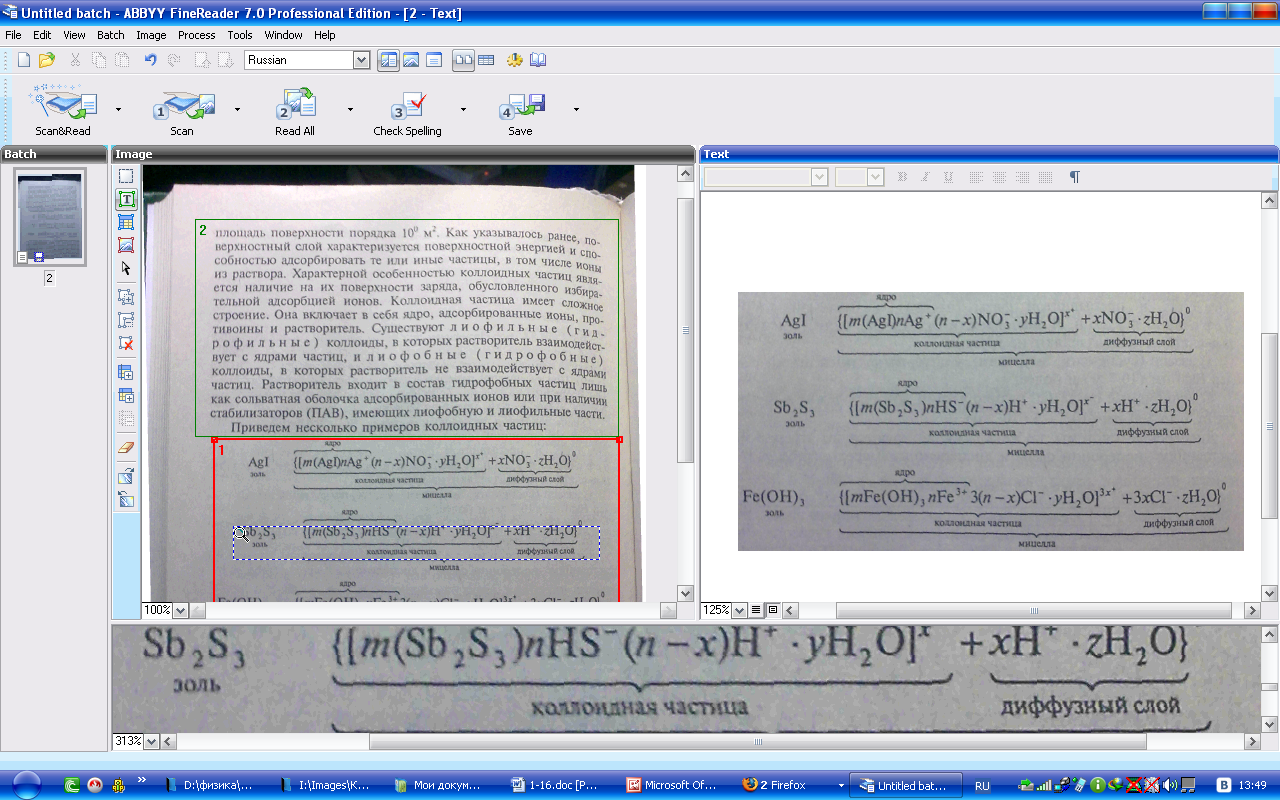
Как. видно, ядро состоит из электронейтрального агрегата частиц с адсорбированными ионами элементов, входящих в состав ядра (в данных примерах ионами Аg+, НS-, Fе3+). Коллоидная час-шца кроме ядра имеет противоионы и молекулы растворителя. Адсорбированные ионы и противоионы с растворителем образуют адсорбированный слой. Суммарно заряд частицы равен разности зарядов адсороированных ионов и противоионов. Вокруг частиц находится д и ф ф у з н ы й с л о и и о н о в, заряд которых равен иряду коллоидной частицы. Коллоидная частица и диффузный слои образуют электронейтральную мицеллу
Мицеллы (уменьшительное от лат. mica — частица, крупинка) — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя. Например, мицелла сульфида мышьяка имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
Средний размер мицелл от 10−5 до 10−7см.
Коагуляция - разделение коллоидного раствора на две фазы – растворитель и студнеобразную массу, или загустевание раствора в результате укрупнения частиц растворенного вещества
Пептизация — процесс перехода коллоидного осадка или геля в коллоидный раствор под действием жидкости или добавленных к ней веществ, хорошо адсорбирующихся осадком или гелем, называемых в этом случае пептизаторами (например, пептизация жиров под действием желчи). Пептизация — разъединение агрегатов частиц гелей (студней) или рыхлых осадков под влиянием определенных веществ — пептизаторов после коагуляции коллоидных растворов. В результате пептизации осадок (или гель) переходит во взвешенное состояние.
24
РАСТВОРЫ, однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными.
Растворимость, способность вещества образовывать с другим веществом (или веществами) гомогенные смеси с дисперсным распределением компонентов (см. Растворы). Обычно растворителем считают вещество, которое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор. Если до растворения оба вещества находились в одном и том же агрегатном состоянии, растворителем считается вещество, присутствующее в смеси в существенно большем кол-ве.
Растворимость определяется физическим и химическим сродством молекул растворителя и растворяемого вещества, соотношением энергий взаимодействием однородных и разнородных компонентов раствора. Как правило, хорошо растворимы друг в друге подобные по физ. и хим. свойствам вещества (эмпирич. правило "подобное растворяется в подобном"). В частности, вещества, состоящие из полярных молекул, и вещества с ионным типом связи хорошо раств. в полярных растворителях (воде, этаноле, жидком аммиаке), а неполярные вещества хорошо раств. в неполярных растворителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная растворимость неэлектролитов возрастает с уменьшением разности их параметров растворимости d=(Е/V)1/2, где Е-теплота испарения, V-полярный объем. Параметр растворимости - одно из осн. понятий, определяющих когезионные свойства веществ в конденсир. состояниях; важная технол. характеристика полимеров и растворителей, лакокрасочных материалов и т.п. (см. Когезия). Р. мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости растворителя. Обычно более растворимы электролиты с большей склонностью к сольватации растворителем; образование кристаллогидратов обычно увеличивает растворимость солей.
Растворимость данного вещества зависит от температуры и давления соответствует общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип). Концентрация насыщенного раствора при данных условиях численно определяет Р. вещества в данном растворителе и также наз. растворимостью. Пересыщенные растворы содержат большее кол-во растворенного вещества, чем это соответствует его растворимости, существование пересыщенных растворов обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы). Для характеристики растворимости малорастворимых веществ используют произведение активностей ПА (для растворов, близких по своим свойствам к идеальному - произведение растворимости ПР).
Способы выражения концентрации растворов.
1) Массовая доля раствора ω (х). Выражается отношением массы растворенного вещества m(х) к массе раствора.
![]()
Является величиной безразмерной или выражается в процентах:
![]()
Например, 15%-ный раствор: массовая доля ω (х) = 0,15
2) Молярная концентрация раствора С(х). Выражается отношением количества растворенного вещества n(x) к объему раствора, выраженному в литрах.
![]()
Т.к. количество вещества n(x) выражается отношением массы вещества m(x) к его молярной массе M(x), то молярную концентрацию раствора удобно выразить как
![]()
