
- •10. Реакции электрофильного присоединения в алкенах. Правило Марковникова с электронной точки зрения.
- •11. Рекция окисления, полимеризации алкенов. Использование продуктов полимеризации в ветеринарии, с/х( полипропилен, полиэтилен и др.).
- •13. Диеновые углеводороды с сопряженными связями. Строение. Дать понятие сопряжению. Способы получения.
- •14. Алкадиены с сопряженными связями. Особенности их поведения в химических реакциях 1,4- и 1,2- присоединения.
- •15. Строение тройной углерод-углеродной связи, ее реакционная способность
- •16. Гомологический ряд алкинов. Способы получения. Физические свойства. Физиологическое действие алкинов. Реакции замещения в Алкинах.
- •17. Взаимодействие алкинов с галогенами, водой, галогеноводородами. Использование продуктов реакции.
- •18. Бензол- ароматическая система. Дать понятия ароматичности. Ее влияние на реакционную способность соединения. Привести примеры ароматических соединений из других классов.
- •Число изомеров в ряду спиртов быстро растет: с5-восемь изомеров, с6- семнадцать, с10- пятьсот семь.
- •30. Реакционная способность глицерина. Применение продуктов реакции.
- •31. Простые и сложные эфиры на основе этанола. Их реакционная способность, практическое применение.
- •32. Способы получения фенолов, использование их в ветеринарии.
- •33. Реакционная способность фенола. Показать взаимное влияние гидроксильной группы и бензольного кольца на их реакционную способность.
- •34. Классификация альдегидов, кетонов. Номенклатура, изомерия. Физические свойства. Строение карбонильной группы. Реакционные центры.
- •35. Получение альдегидов и кетонов. Распространение в природе. Использование в ветеринарии и медицине.
- •36. Реакции замещения в альдегидах и кетонах по функциональной группе и по радикалу.
- •37. Реакции присоединения, идущие в альдегидах. Кетонах. Использование и распространение в природе продуктов реакции.
- •38. Получение полуацеталей (полукеталей). Значение этих реакций в химии углеводов.
- •39. Реакции полимеризации и конденсации альдегидов и кетонов. Их отличие.
- •64.Простые липиды(жиры). Классиф-я, распр-ние в природе,хим.Св-ва. Применение.
- •70. Аминоспирты. Строение. Распространение в природе. Холин. Коламин. Химические свойства.
- •71. Диамины. Путресцин. Кадаверин. Способы получения из аминокислот. Физ и хим свойства.
- •72. Анилин – ароматический амин. Физ и хим свойства. Использование производных анилина в ветеринарии, медицине. Сульфаниламидные препараты.
- •73. Амиды карбоновых кислот. Мочевина. Свойства, применение в сельском хозяйстве. Строение глутамина и аспарагина.
- •74. Аминокислоты. Строение. Биполярность аминокислот. Амфотерные свойства аминокислот. Строение и свойства глутамина и аспарагина. Электрофорез.
- •75. Химические свойства а-аминокислот. Реакции, идущие по nh2-группе.
- •76. Химические свойства аланина. Реакции, идущие по карбоксильной группе.
- •77. Отношение к нагреванию а,в,V аминокислот (дигидратация). Лактамы. Дикетопиперазины.
- •78. Белки. Общие представления о строении белков. Структурная организация белков. Денатурация.
- •79. Белки. Классификация. Протеины. Протеиды. Биологическая роль белков.
- •80. Пиридин как представитель шестичленных азотистых гетероциклов. Свойства. Биологически активные соединения на его основе. Никотиновая кислота.
- •81. Конденсированные азотистые гетероциклы. Индол и биологически активные соединения на его основе(триптофан, индолилуксусная кислота, триптамин).
- •82. Пиримидиновые азотистые основания и нуклеотиды на их основе.
- •83. Шестичленные азотистые гетероциклы с двумя гетероатомами. Пиримидин, цитозин, урацил, тимин.
- •84. Нуклеиновые кислоты. Нуклеозид, нуклеотид. Строение. Привести пример динуклеотида.
18. Бензол- ароматическая система. Дать понятия ароматичности. Ее влияние на реакционную способность соединения. Привести примеры ароматических соединений из других классов.
б+
б- б + б-
СН3->СН=СН2
+ Н- Вг —CH3-CHBr-CH3
2
бромпропан
В настоящее время к ароматическим углеводородам относят углеводороды ряда бензола (СпН2п-б) и ряд соединений небензойного характера, но удовлетворяющие ряду требований (признаков):
1.Соединение ароматично, если оно имеет плоский замкнутый цикл.
2.Соединение ароматично, если присутствует сопряжение.
3. Соединение ароматично, если согласно правилу Хюккеля число р-электронов, образующих π-связи, равно (4п+2), где п=0, 1, 2, 3...(натуральные числа).
Все ароматические соединения обладают следующими свойствами:
1.Термодинамическая устойчивость. Молекулы обладают значительно меньшей энергией, чем это следует из теоретических расчетов.
2.Реакции замещения в этих системах идут значительно легче, чем реакции присоединения, несмотря на то, что в их структуре имеются непредельные связи.
3. Реакции окисления идут только в жестких условиях
Примеры ароматических соединений: Толуол C6H5-CH3
![]() К
ароматическим системам также относятся
конденсированные циклы: нафталин,
фенантрен и антрацен:
К
ароматическим системам также относятся
конденсированные циклы: нафталин,
фенантрен и антрацен:
Нафталин
![]() С10Н8
Фенантрен
С10Н8
Фенантрен
![]() C14H10
Антрацен
C14H10
Антрацен
![]() С14Н10
С14Н10
А также некоторые гетероциклы. Например,
![]() Фуран
C4H4O
Фуран
C4H4O
С точки зрения ароматичности рассмотрим бензол.
1. Система плоская, циклическая. Все о-связи лежат в одной плоскости.
2 Число р-электронов π-связей равно 6 при n=1 (4n+2=6).
3. Углерод в состоянии sp2-гибридизации. Шесть р- орбиталей, образующих π-связи, расположены перпендикулярно плоскости молекулы и параллельны друг другу.
Все они перекрываются, образуя единую делокализованную
систему, с наибольшей электронной плотностью над и под плоскостью кольца, т.е. имеет место сопряжение, π-электронная плотность равномерно распределена по всей системе. Это явление отражается в формуле бензола в виде кольца, а не отдельных связей:
Бензол
как ароматическая система обладает
меньшим запа сом энергии, чем рассчитанная
теоретически, на 160 КДж/моль
![]() .
.
19. Бензол. Гомологический ряд бензола. Строение. Физические св-ва. Реакции парисоединения. Инсектициды.
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом. Простейший ароматический углеводород. .
Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д
Физические свойства
Бензол (жидкий)
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно всем углеводородам бензол горит и образует много копоти. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91% бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Инсектици́ды (от лат. insectum — насекомое и лат. caedo — убиваю) — химические препараты для уничтожения вредных насекомых. Инсектициды различны по химическому составу:
хлорорганические (ДДТ, гексахлоран и др.)
фосфорорганические (тиофос, карбофос, метилмеркаптофос, дихлофос, диазинон, хлорпирифос и др.)
производные карбаминовой кислоты (метилкарбамат), (пропоксур),
природные пиретрины и синтетические пиретроиды (циперметрин)
препараты, содержащие мышьяк (арсениты кальция и натрия, арсенат кальция)
препараты серы
минеральные масла
яды растительного происхождения, содержащие алкалоиды (анабазин, никотин)
неоникотиноиды (имидаклоприд, тиаметоксам),
ингибиторы синтеза хитина (дифлубензурон)
фенилпиразолы (фипронил)
Реакции присоединения. Ароматические углеводороды способны вступать в реакции присоединения (гидрирования, хлорирования).
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.

Практическое значение имеет радикальное хлорирование бензола для получения "гексахлорана" (средство борьбы с вредными насекомыми).
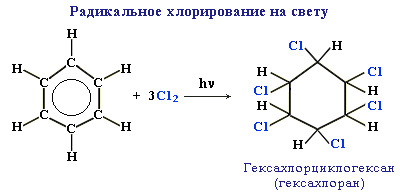
Эти реакции идут с трудом Например, этилен гидрируется 1 час, а бензол - 25 часов.
Без катализаторов и без облучения галогены не реагируют с бензолом, а растворяются в нем
Гесахлоран - инсектицид, т.е. химическое средство для уничтожения насекомых. На основе бензола был синтезирован еще один инсектицид - ДДТ.
Серьезной проблемой при применении инсектицидов является проблема привыкания насекомых к действию препарата. Так произошло с ДДТ, у насекомых появилась к нему устойчивость
Большинство полихлорпроизводных плохо разлагаются в природных условиях, накапливаются в организме животных. В связи с этим, после применения ДДТ в течение 40 лет,
20.
методы получения бензола и его гомологов.
Физиологическое действие конденсированных
ароматических соединений.
Физиологическое действие конденсированных
ароматических соединений. 1) получение
из алифатических углеводородов. Для
получения бензола и его гомологов в
промышленности используют ароматизацию
предельных углеводородов, входящих в
состав нефти. При пропускании алканов
с неразветвленной цепью , имеющих не
менее 6 атомов углерода в молекуле, над
нагретой платиной происходит дегидрирование
с одновреименным замыканием цикла(
дегидроциклизация)
![]()
2)
Дегидрирование циклоалканов также
приводит к ароматическим углеводородам.
Реакция происходит при пропускании
паров циклогексана и его гомологов над
нагретой платиной.
![]()
3)
Бензол можно получить при тримеризации
ацетилена. Реакция происходит при
пропускании ацетилена над активированным
углём при 600°С.
![]()
4)
Гомологи бензола получают из бензола
при его взаимодействии с алкилгалогенидами
в присутствии галогенидов алюминия(
реакция алкилирования,или
Фриделя- Крафтса)
![]()
5)
при сплавлении солей ароматических
кислот со щёлочью выделяются арены в
газообразном виде.
![]()
Два
ароматических кольца, имеющих два общих
углеродных атома называются
конденсированными. Простейший
представитель ароматических соединений
с двумя конденсированными ядрами -
нафталин.
![]()
Существуют ароматические соединения с тремя конденсированными ядрами - антрацен, фенантрен.
В
конденсированных ароматических
соединениях два соседних "срощенных"
цикла имеют два общих атома.
При этом возможны три типа сочленения
циклов: линейное, угловое,
пери-сочленение. Многие
конденсир. ароматические соединения
имеют тривиальные назв., например
нафталин, антрацен, фенантрен.
названия более сложных систем основаны
на этих тривиальных назв. с добавлением
соответствующей приставки и индекса
(в квадратных скобках), указывающего
место конденсации.
например:
![]()
21)галогенирование,нитрование,
сульфирование , алкилирование,ацилирование
бензола. Использование продуктов
реакции.Галогенирование. Бензол
не взаимодействует с хлором или бромом
в обычных условиях. Реакция может
протекать только в присутствии
катализаторов — безводных АlСl3,
FeСl3,
АlВr3.
В результате реакции образуются
галогенозамещенные арены:
![]() Нитрование. Бензол
очень медленно реагирует с концентрированной
азотной кислотой даже при сильном
нагревании. Однако при действии так
называемойнитрующей
смеси (смесь концентрированных азотной
и серной кислот) реакция
нитрования проходит достаточно легко:
Нитрование. Бензол
очень медленно реагирует с концентрированной
азотной кислотой даже при сильном
нагревании. Однако при действии так
называемойнитрующей
смеси (смесь концентрированных азотной
и серной кислот) реакция
нитрования проходит достаточно легко:
![]()
Сульфирование. Реакция
легко проходит под действием “дымящей”
серной кислоты (олеума):
![]()
Алкилирование
по Фриделю—Крафтсу. В
результате реакции происходит введение
в бензольное ядро алкильной группы с
получением гомологов бензола. Реакция
протекает при действии на бензол
галогеналканов RСl в присутствии
катализаторов — галогенидов алюминия.
![]()
Алкилирование
алкенами. Эти
реакции широко используются в
промышленности для получения этилбензола
и изопропилбензола (кумола). Алкилирование
проводят в присутствии катализатора
АlСl3.
![]()
Ацилирование по Фриделю–Крафтсу. В качестве реагентов ацилирования используются галогенангидриды и ангидриды кислот. Если при алкилировании расходуются каталитические количества AlCl3, то при ацилировании – минимум 2 моля: комплекс с реагентом + комплекс с продуктом + комплекс с кислотой (если используется ангидрид).
22) Реакции замещения в ароматических углеводородах на примере толуола и бензальдегида. Влияние заместителей на направление электрофильного замещения. Орто-, пара- и мета- ориентанты.( первую часть вопроса не знаю.)
--- Влияние заместителей, передающееся по сопряженной системе p -связей, называется мезомерным (М) эффектом. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные. Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. В результате электронная плотность сосредоточивается в орто- и пара-положениях. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называютсязаместителями (ориентантами) первого рода.
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называютсязаместителями (ориентантами) второго рода. Мета-, орто-, пара- -приставки, употребляемые в органической химии для обозначения положения двух одинаковых или различных заместителей относительно друг друга в бензольном кольце. Так, у мета-соединений заместители находятся в 1,3-положениях, у орто-соединений — в 1,2-, у пара-соединений — в 1,4-положениях.
23. Алканолы. Атомность спиртов. Сравнить взаимодействие одноатомных и многоатомных спиртов с металлами, гидроксидами металлов. Алканолы- одноатомные насыщенные спирты. Спирты классифицируют на первичные(метанол,этанол), вторичные(пропанол-2) и третичные(2-метилпропанол-2) в зависимости
о![]() ттого,
с каким атомом углерода (связана
гидроксильная группа). Атом углерода
считается первичным, вторичным третичным
в зависимости от числа связанных с ним
других атомов углерода.
Производные
углеводородов, в которых один или
несколько атомов водорода замещены на
гидроксильную группу ОН. Называются
спиртами.В зависимости от числа
гидроксильных групп, спирты подразделяют
на одно-
(метанол),
двух-
(этиленгликоль),
трех-( глицерин),четырёхатомные
спирты (пентаэритрит);и
многоатомные
спирты (пятиатомный
спирт: ксилит)..Кислотные
свойства спиртов выражены очень слабо.
Низшие спирты бурно реагируют со
щелочными металлами.
многоатомные
спирты проявляют более кислые свойства,
чем одноатомные и легко образуют
алкоголяты не только с металлами, но и
с гидроксидами тяжелых металлов. В
отличие от одноатомных спиртов,
многоатомные с
ттого,
с каким атомом углерода (связана
гидроксильная группа). Атом углерода
считается первичным, вторичным третичным
в зависимости от числа связанных с ним
других атомов углерода.
Производные
углеводородов, в которых один или
несколько атомов водорода замещены на
гидроксильную группу ОН. Называются
спиртами.В зависимости от числа
гидроксильных групп, спирты подразделяют
на одно-
(метанол),
двух-
(этиленгликоль),
трех-( глицерин),четырёхатомные
спирты (пентаэритрит);и
многоатомные
спирты (пятиатомный
спирт: ксилит)..Кислотные
свойства спиртов выражены очень слабо.
Низшие спирты бурно реагируют со
щелочными металлами.
многоатомные
спирты проявляют более кислые свойства,
чем одноатомные и легко образуют
алкоголяты не только с металлами, но и
с гидроксидами тяжелых металлов. В
отличие от одноатомных спиртов,
многоатомные с![]() пирты
реагируют с гидроксидом меди, давая
комплексы синего цвета (качественная
реакция на многоатомные спирты).
пирты
реагируют с гидроксидом меди, давая
комплексы синего цвета (качественная
реакция на многоатомные спирты).
24)Способы получения одноатомных спиртов. Метанол, этанол.1)Общий способ получения спиртов- гидратация алкенов. Реакция идёт при пропускании алкена с парами воды над фосфорнокислым катализатором. Из этилена получается этиловый спирт, из пропена- изопропиловый. Присоединение идёт по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт. 2) Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей:
R—Br + NaOH → R—OH + NaBr. По этой реакции можно получать первичные, вторичные и третичные спирты.3) Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:
R—CH=O + Н2 → R—CH2—OH, (1)
R—CO—R' + Н2 → R—CH(OH) —R'. (2)
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
O // 2H H3C—C – H3C—CH2OH \ H уксусный этиловый альдегид спирт
2H H3C—CO—CH3 – H3C—CH—CH3 | OH ацетон изопропиловый спирт
4)Этанол получают при спиртовом брожении глюкозы: С6Н12О6 → 2С2Н5ОН + 2СО2↑.
Метиловый спирт, метанол, древесный спирт, CH3OH, бесцветная жидкость с запахом, подобным запаху этилового спирта; обладает всеми свойствами одноатомных спиртов. Смешивается во всех соотношениях с водой и многими органическими растворителями. Метиловый спирт ядовит, он горит бледно-голубым некоптящим пламенем. В природе метиловый спирт в свободном состоянии почти не встречается. Распространены его производные — эфирные масла,сложные эфиры. Метиловый спирт широко используется в промышленности как растворитель лаков, красок, как исходное вещество для получения хлористого метила, диметилсульфата, формальдегида и ряда других химических соединений. Он применяется для денатурации этилового спирта,
ЭТИЛОВЫЙ СПИРТ (этанол, метилкарбинол, винный спирт) C2H5OH бесцв. легкоподвижная жидкость с характерным запахом и жгучим вкусом. Этиловый спирт смешивается во всех соотношениях с водой, спиртами,диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином. С металлами образует этилаты. С неорг. и орг. к-тами, ангидридами, галогенангидридами - сложные эфиры, напр. с Н2SO4 этилсульфат С2Н5ОSО3Н. В пром-сти этиловый спирт получают анаэробным брожением углеводов растит. происхождения в присут. дрожжей игидратацией этилена. Этиловый спирт - р-ритель в лакокрасочной и фармацев-тич. пром-сти, в произ-ве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, в качестве сырья для получения многих промышленных продуктов, например бутадиена, этилацетата. Этиловый спирт из пищ. сырья часто используют для получения чистого этилена.
Взаимодействует со щелочными металлами с образованием этилатов (или в общем случае — алкоголятов) и водорода. 2C2H5OH + 2К = 2С2Н5ОК + Н2.
Реагирует с карбоновыми кислотами с образованием сложных эфиров:
RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O
25)Изомерия одноатомных спиртов на примере бутанола. Отличие в реакциях окисления первичных, вторичных, третичных спиртов. Сложные эфиры. Их использование. Изомерия предельных одноатомных спиртов обусловлена изомерией углеродного скелета и изомерией положения ОН- группы. Метиловый и этиловый спирты не имеют изомеров. В зависимости от положения гидроксильной группы при первичном, вторичном или третичном углеродном атоме спирты могут быть первичными, вторичными, третичными:
Для бутанола могут быть выведены 4 изомера: СН3-СН2-СН2-СН2-ОН - Бутанол-1 СН3-СН(ОН)-СН2СН3 - бутанол-2 (СН3)2СН-СН2-ОН - 2-метилпропанол-1 (изо-бутанол) (СН3)3С-ОН - 2-метилпропанол-2 (трет-бутанол)
