
- •Равновесие в системе раствор-осадок. Растворимость. Произведение растворимости. Понятие о константе растворимости. Факторы, влияющие на образование и растворение осадков.
- •1. Растворы.
- •2. Процесс растворения.
- •3. Растворимость.
- •4. Ненасыщенные, насыщенные и перенасыщенные растворы.
- •5. Способы выражения концентрации растворов.
- •1) Массовая доля растворённого вещества ω(х)
- •6. Произведение растворимости.
- •7. Факторы, влияющие на образование и растворение осадков.
- •1) Влияние концентрации растворов.
- •2) Влияние количества осадителя.
- •3) Влияние одноименного иона.
- •4) Влияние температуры.
- •5) Влияние рН раствора.
Равновесие в системе раствор-осадок. Растворимость. Произведение растворимости. Понятие о константе растворимости. Факторы, влияющие на образование и растворение осадков.
1. Растворы.
Системы, полученные в результате распределения одного вещества в виде мелких частиц в другом, называются дисперсными. Вещество, которое распределяется, называется дисперсной фазой (растворимое вещество), а вещество, в котором распределяется дисперсная фаза, называется дисперсионной средой или растворителем. И растворимое вещество и растворитель могут быть в трех агрегатных состояниях (водные растворы солей – Ж-Т; раствор спирта в воде – Ж-Ж; туман – Г-Ж; дым – Г-Т и др.). Наибольшее значение имеют системы, в которых растворителем является жидкость. В зависимости от агрегатного состояния и размера частиц растворяемого вещества дисперсные системы делятся на:
Грубодисперсные (суспензии, эмульсии). В грубодисперсных системах частицы дисперсной фазы имеют размер ≥ 100 нм и могут быть либо жидкими (эмульсией) либо твердыми (суспензии). Примером эмульсий могут служить молоко, маргарин, крем, мазь; примером суспензий – взвесь ила в воде, мел в воде.
Тонкодисперсные (коллоидные растворы). Частицы растворимого вещества твердые и имеют размеры 1-100 нм.
Истинные растворы. В истинных растворах растворимое вещество диспергировано до отдельных атомов, молекул или ионов – частиц, размер которых ≤ 1 нм.
Истинные растворы подразделяются:
По типу растворителя – водные и неводные
По типу растворенного вещества – на растворы солей, кислот, щелочей, газов и т.п.
По отношению к электрическому току – на электролиты и неэлектролиты
По концентрации – на концентрированные и разбавленные
По степени достижения предела растворимости – на насыщенные и ненасыщенные.
2. Процесс растворения.
Растворение – это сложный физико-химический процесс. С физической точки зрения происходит разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя. Физическая теория развивалась благодаря трудам Вант-Гоффа, Аррениуса. С химической точки зрения, происходит взаимодействие молекул растворителя с частицами растворенного вещества. Химическую теорию создал Менделеев.
Физический процесс идет с поглощением энергии, химический - с выделением.
Если в результате растворения выделяется больше энергии, чем ее поглощается при разрушении структуры вещества, то растворение - экзотермический процесс. Выделение энергии происходит при растворении NaOH, H2SO4, Na2CO3, ZnSO4 и других веществ. Если для разрушения структуры вещества надо больше энергии, чем ее выделяется при гидратации, то растворение - эндотермический процесс. Поглощение энергии происходит при растворении в воде NaNO3, КС1, NH4NO3, K2SO4, KNO2, NH4C1 и других веществ.
Количество энергии, которое выделяется или поглощается при растворении, называется тепловым эффектом растворения.
3. Растворимость.
Растворимость – способность веществ равномерно распределятся в виде атомов, молекул или ионов по всему объему растворителя. Количественно растворимость выражают коэффициентом растворимости. Коэффициент растворимости показывает, какая максимальная масса веществ может раствориться в 1 л растворителя при данной температуре. Растворимость выражают в г/л. По растворимости в воде вещества делят на 3 группы:
Хорошо растворимые (≥10 г вещества в 1 л воды, пример – глюкоза в 1 л воды растворяется 2000 г).
Малорастворимые (от 0,01 до 10 г вещества в 1 л воды, пример СаSO4 в 1 литре воды растворяется 2 г).
Практически нерастворимые (≤0,01 г вещества в 1 л воды, пример AgCl в 1 литре воды растворится 1,5×10-3 г).
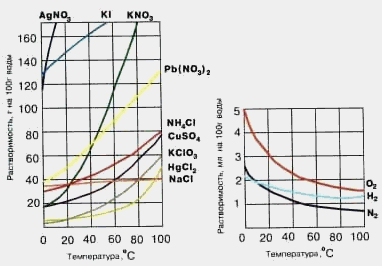
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления – увеличивается. Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих веществ увеличивается при повышении температуры.
•Молярная растворимость вещества (S, моль/л)–количество растворенного вещества в 1 л его насыщенного раствора:
S = n/V или S = m / M∙V
где: n–количество растворенного вещества, моль
m–масса растворенного вещества, г
M–молярная масса растворенного вещества, г/моль
V–объем насыщенного раствора, л
•Массовая растворимость вещества (Т, г/л)–это масса растворенного вещества в 1 л его насыщенного раствора:
Т= m / V или Т = S ∙ M
