
- •1.Основні положення мкт та їх дослідне обґрунтування. Маса і розмір молекул. Стала Авогадро. Швидкість теплового руху молекул. Дослід Штерна.
- •2.Ідеальний газ. Основне рівняння мкт ідеального газу. Температура та її вимірювання. Шкала абсолютних температур.
- •3.Рівняння стану ідеального газу (рівняння Менделєєва-Клапейрона). Ізопроцеси в газах
- •5.Необоротність теплових процесів. Принцип дії теплових двигунів. Ккд теплового двигуна і його максимальне значення. Теплові двигуни і проблеми охорони навколишнього середовища.
- •6.Пароутворювання (випаровування та кипіння). Конденсація. Питома теплота пароутворення. Насичена і ненасичена пара, їхні властивості. Вологость повітря та її вимірювання.
- •7.Плавлення і кристалізація тіл. Питома теплота плавлення. Птиома теплота згоряння палива. Рівняння теплового балансу для найпростіших теплових процесів.
- •8.Поверхневий натяг рідини. Сила поверхневого натягу. Змочування. Капілярні явища.
- •9.Кристалічні та аморфні тіла. Механічні властивості твердих тіл. Види деформації. Модуль Юнга.
Молекулярна фізика
Молекулярна фізика — це розділ фізики, в якому закони механіки застосовуються не до кожної окремої молекули речовини, а до величезної їх сукупності. При цьому використовуються усереднені фізичні величини (середні швидкість і енергія молекули, середні густина, тиск і т. ін.). Молекулярна фізика вивчає фізичні властивості речовин у різних агрегатних станах.
Основи молекулярнокінетичної теорії. Броунівський рух
Основні
положення молекулярно-кінетичної теорії
(МКТ) речовини:
1) усі тіла складаються
із частинок — молекул, атомів і йонів;
2)
частинки перебувають у безперервному
хаотичному русі;
3) між частинками
будь-якого тіла існують сили взаємодії.
Одним
із перших підтверджень положень МКТ
стали досліди англійського ботаніка
Роберта Броуна, проведені в 1827 р.
Розглядаючи в мікроскоп краплину води,
в якій містився квітковий пилок, учений
виявив безладний рух частинок пилку.
Потім Броун і його послідовники
спостерігали аналогічний рух інших
частинок (різних за розміром, із різних
речовин, у тому числі й
неорганічних).
 Броунівський
рух частинок
пояснюється некомпенсованими безладними
зіткненнями з ними величезної кількості
невидимих у мікроскоп молекул
рідини.
Поняття моля речовини та
закони Авогадро розглядаються і в
хімії. Моль —
одиниця кількості речовини
Броунівський
рух частинок
пояснюється некомпенсованими безладними
зіткненнями з ними величезної кількості
невидимих у мікроскоп молекул
рідини.
Поняття моля речовини та
закони Авогадро розглядаються і в
хімії. Моль —
одиниця кількості речовини ![]() .
Моль — це кількість речовини, яка містить
стільки ж її структурних складових
(наприклад, атомів або молекул), скільки
міститься атомів в 0,012 кг вуглецю.
За
сучасним стандартом, хімічний елемент,
з якого складається речовина і яка
названа тут вуглецем, отримав назву Карбон.
Із хімії також відомо, що один і той
самий елемент може існувати у вигляді
кількох ізотопів (чи нуклідів); вище
йшлося про Карбон
.
Моль — це кількість речовини, яка містить
стільки ж її структурних складових
(наприклад, атомів або молекул), скільки
міститься атомів в 0,012 кг вуглецю.
За
сучасним стандартом, хімічний елемент,
з якого складається речовина і яка
названа тут вуглецем, отримав назву Карбон.
Із хімії також відомо, що один і той
самий елемент може існувати у вигляді
кількох ізотопів (чи нуклідів); вище
йшлося про Карбон ![]() .
Італійський
фізик і хімік Амедео Авогадро у 1811 р.
виявив, що різні гази, які займають
однаковий об’єм за однакових умов,
містять однакове число молекул. В одному
молі це число (стала
Авогадро)
дорівнює:
.
Італійський
фізик і хімік Амедео Авогадро у 1811 р.
виявив, що різні гази, які займають
однаковий об’єм за однакових умов,
містять однакове число молекул. В одному
молі це число (стала
Авогадро)
дорівнює: ![]() .
Крім того, Авогадро довів, що за нормальних
значень тиску й температури моль
будь-якого газу займає однаковий
об’єм:
.
Крім того, Авогадро довів, що за нормальних
значень тиску й температури моль
будь-якого газу займає однаковий
об’єм: ![]() .
Якщо позначити масу одного моля M, то
маса однієї молекули:
.
Якщо позначити масу одного моля M, то
маса однієї молекули: ![]() .
Приклад:
маса молекули кисню
.
Приклад:
маса молекули кисню
![]() .
Значення M знаходять,
користуючись таблицею Менделєєва, а
якщо речовина не атомарна, то ще й
формулою речовини. Наприклад:
.
Значення M знаходять,
користуючись таблицею Менделєєва, а
якщо речовина не атомарна, то ще й
формулою речовини. Наприклад:
![]() ,
, ![]() ,
,
![]()
![]() .
Оцінюючи
розмір деякої молекули, будемо вважати,
що молекула являє собою маленьку, щільно
впаковану кульку, тоді її об’єм
дорівнює
.
Оцінюючи
розмір деякої молекули, будемо вважати,
що молекула являє собою маленьку, щільно
впаковану кульку, тоді її об’єм
дорівнює ![]() .
Із формули густини речовини
.
Із формули густини речовини ![]() випливає:
випливає: ![]() .
Для
однієї молекули
.
Для
однієї молекули
![]() .
Звідси
для молекули води:
.
Звідси
для молекули води:
![]() Таким
чином, молекули настільки малі, що за
допомогою оптичних мікроскопів побачити
їх не можна.
Таким
чином, молекули настільки малі, що за
допомогою оптичних мікроскопів побачити
їх не можна.
Взаємодія атомів і молекул речовин у різних агрегатних станах
Сили
взаємодії молекул речовини мають
електричне походження й зумовлені як
відштовхуванням ядер атомів сусідніх
молекул речовини, так і притяганням між
ядрами одних атомів і електронними
оболонками інших. Графіки залежності
сил відштовхування і сил притягання
від відстані між двома сусідніми
частинками мають різну крутизну.
Залежність результуючої сили ![]() від r при
малих r схожа
на залежність
від r при
малих r схожа
на залежність ![]() ,
а при великих — на залежність
,
а при великих — на залежність ![]() .
Молекули
речовини, яка перебуває в газоподібному
стані, настільки віддалені одна від
одної, що практично не взаємодіють (лише
відштовхуються при зіткненнях). В інших
агрегатних станах речовин молекули
взаємодіють, причому Fрез
тим більша, чим менший r; отже,
.
Молекули
речовини, яка перебуває в газоподібному
стані, настільки віддалені одна від
одної, що практично не взаємодіють (лише
відштовхуються при зіткненнях). В інших
агрегатних станах речовин молекули
взаємодіють, причому Fрез
тим більша, чим менший r; отже, ![]() .
.

Ідеальний газ. Основне рівняння мкт ідеального газу
Подібно
до використання в механіці ідеалізованого
поняття матеріальної точки, в молекулярній
фізиці використовують поняттяідеального
газу як
величезної сукупності матеріальних
точок, які не взаємодіють одна з одною
на відстані.
За умови достатньо
низького тиску і високої температури
реальні гази (азот, кисень та ін.) за
своїми властивостями близькі до моделі
ідеального газу.
Основним
рівнянням МКТ ідеального
газу є математичний вираз тиску газу
через концентрацію його молекул ![]() (де V —
об’єм), масу кожної молекули
(де V —
об’єм), масу кожної молекули ![]() і
квадрат середньої швидкості молекули:
і
квадрат середньої швидкості молекули:
![]() .
.
Рівняння Менделєєва — Клапейрона
Величини p, V і T,
які визначають стан газу, називають
параметрами стану. Рівняння, до складу
якого одночасно входять всі параметри,
називається рівнянням
стану.
Тиск p газу
залежить від значень T і V:![]() .
Перехід від пропорційності до рівняння
спочатку було здійснено за допомогою
коефіцієнта, який мав стале значення
(був константою) для даного газу, але
мав різні значення для інших газів (ця
константа не була універсальною). Таким
чином було одержано рівняння стану,
назване рівнянням Клапейрона:
.
Перехід від пропорційності до рівняння
спочатку було здійснено за допомогою
коефіцієнта, який мав стале значення
(був константою) для даного газу, але
мав різні значення для інших газів (ця
константа не була універсальною). Таким
чином було одержано рівняння стану,
назване рівнянням Клапейрона:
![]() .
Коефіцієнт
пропорційності став універсальним
завдяки Дмитру Менделєєву, який
запропонував розглядати різні гази в
однакових кількостях, тому рівняння
стало називатися рівнянням Менделєєва
— Клапейрона.
Для 1 моль газу
.
Коефіцієнт
пропорційності став універсальним
завдяки Дмитру Менделєєву, який
запропонував розглядати різні гази в
однакових кількостях, тому рівняння
стало називатися рівнянням Менделєєва
— Клапейрона.
Для 1 моль газу
![]() ,
або
,
або ![]() .
Величина
.
Величина ![]() називається універсальною (або молярною) газовою
сталою.
Для n моль:
називається універсальною (або молярною) газовою
сталою.
Для n моль:
![]() .
.
Температура та її вимірювання
Результатом
спільного розв’язання записаних для
1 моль основного рівняння МКТ ![]() і
рівняння Менделєєва — Клапейрона
і
рівняння Менделєєва — Клапейрона ![]() є
вираз
є
вираз
![]() ,
де
,
де ![]() —
стала Больцмана.
Отже:
—
стала Больцмана.
Отже: ![]() ,
або
,
або ![]() ,
тобто температура —
це фізична величина, яка є кількісною
мірою середньої енергії теплового руху
молекул газу.
Дія приладів для
вимірювання температури базується на
різних фізичних ефектах. Найбільш
поширені рідинні (спиртові
й ртутні) термометри, в основі дії яких
лежить теплове розширення рідин. Є також
термометри газові (термометри
тиску), електричні(термометри
опору) та ін.
,
тобто температура —
це фізична величина, яка є кількісною
мірою середньої енергії теплового руху
молекул газу.
Дія приладів для
вимірювання температури базується на
різних фізичних ефектах. Найбільш
поширені рідинні (спиртові
й ртутні) термометри, в основі дії яких
лежить теплове розширення рідин. Є також
термометри газові (термометри
тиску), електричні(термометри
опору) та ін.
Швидкість молекул ідеального газу
Уже
відзначалось, що молекули газів рухаються
хаотично, тому можна говорити тільки
про середню
швидкість.
Із
виразу ![]() отримують
формулу середньої квадратичної швидкості
молекули
отримують
формулу середньої квадратичної швидкості
молекули ![]() .
Для зручності домножують і ділять
підкорінний вираз на
.
Для зручності домножують і ділять
підкорінний вираз на ![]() .
Тоді
.
Тоді ![]() .
.
Ізопроцеси в газах. Абсолютна температурна шкала
Процес
у газі — це будь-яка дія, що змінює його
стан (нагрівання, охолодження, стиснення).
При цьому можуть змінюватись або всі
три параметри стану, або два, або навіть
один.
Значний інтерес при аналізі
пове-дінки газів становлять
ізопроцеси. Ізопроцесами називаються
процеси, що відбуваються в системі з
незмінною масою за сталого значення
одного з параметрів стану системи.
Алгебраїчні описи ізопроцесів найпростіше
отримати, записавши рівняння Клапейрона
для двох станів газу:![]() .
При
застосуванні цього рівняння по черзі
для кожного ізопроцесу параметр, сталий
у конкретному випадку,
скорочується.
1)
.
При
застосуванні цього рівняння по черзі
для кожного ізопроцесу параметр, сталий
у конкретному випадку,
скорочується.
1) ![]() (ізотермічний
процес). При цьому
(ізотермічний
процес). При цьому ![]() (
(![]() —
закон Бойля — Маріотта). Графік цього
процесу — ізотерма (а).
2)
—
закон Бойля — Маріотта). Графік цього
процесу — ізотерма (а).
2) ![]() (ізобарний
процес). При цьому
(ізобарний
процес). При цьому ![]()
![]() —
закон Гей-Люссака). Графік цього процесу
— ізобара (б).
3)
—
закон Гей-Люссака). Графік цього процесу
— ізобара (б).
3) ![]() (ізохорний
процес).
(ізохорний
процес).![]()
![]() —
закон Шарля). Формула Шарля у шкалі
Цельсія:
—
закон Шарля). Формула Шарля у шкалі
Цельсія: ![]() ,
де
,
де ![]() —
температурний коефіцієнт тиску. Графік
цього процесу — ізохора (в).
—
температурний коефіцієнт тиску. Графік
цього процесу — ізохора (в).
 Графік
закону Шарля в координатах р і t допомагає
легко перейти від температури t до T:
якби до найнижчих температур речовина
залишалась газоподібною, її тиск зникав
би при
Графік
закону Шарля в координатах р і t допомагає
легко перейти від температури t до T:
якби до найнижчих температур речовина
залишалась газоподібною, її тиск зникав
би при ![]() .
Саме цю температуру англійський фізик
Уїльям Томсон (Кельвін) запропонував
розглядати як нуль у так званій абсолютній
чи термодинамічній шкалі температур.
Отже:
.
Саме цю температуру англійський фізик
Уїльям Томсон (Кельвін) запропонував
розглядати як нуль у так званій абсолютній
чи термодинамічній шкалі температур.
Отже: ![]() .
.
Насичена і ненасичена пара. Залежність температури кипіння рідини від тиску
У 8 класі уже розглядались процеси пароутворення шляхом випаровування і кипіння, одночасно з якими відбувається зворотний процес — конденсація. Якщо випаровування перевищує конденсацію, пара над рідиною ненасичена. При взаємному зрівноваженні цих процесів пара насичена. Чим вища температура, тим більший тиск насиченої пари. Температура кипіння рідини зале-жить від зовнішнього тиску. Вона зростає при збільшенні тиску (це використовується в харчовій промисловості й медицині для створення автоклавів). При зниженні тиску температура кипіння знижується (високо у горах окріп виявляється «прохолодкуватим», а яйце не вдається зварити вкруту).
Вологість повітря. Точка роси
Тиск
водяної пари, що міститься в повітрі,
окремо виміряти неможливо. Цей тиск
парціальний (від англ. part —
частина) і складає частину тиску,
вимірюваного барометром.
Можна
сказати й інакше: парціальний тиск
дорівнює тиску, що його створювала б
водяна пара, якби крім неї в якійсь
ділянці простору не було інших газоподібних
компонентів.
Вміст водяної пари в
повітрі називають вологістю
повітря.
Розрізняють абсолютну і відносну
вологість.
Абсолютна
вологість —
це парціальний тиск пари в повітрі ![]() або
густина цієї пари
або
густина цієї пари ![]() .
Відносна
вологість
.
Відносна
вологість![]() —
це відношення парціального тиску пари
в повітрі (або густини пари) до тиску
(або густини) насиченої пари за даної
температури:
—
це відношення парціального тиску пари
в повітрі (або густини пари) до тиску
(або густини) насиченої пари за даної
температури:
![]() .
При
зниженні температури повітря водяна
пара, що міститься в ньому, стає все
ближчою до стану насичення. Температура,
при якій водяна пара в повітрі стає
насиченою, називається точкою
роси.
.
При
зниженні температури повітря водяна
пара, що міститься в ньому, стає все
ближчою до стану насичення. Температура,
при якій водяна пара в повітрі стає
насиченою, називається точкою
роси.
Властивості поверхні рідини. Поверхневий натяг
Поверхневий
шар рідини відрізняється від внутрішніх
шарів тим, що його молекули з одного
боку мають зовсім інших сусідів, ніж
молекули інших шарів.
 На
межі з повітрям рідина має вільну
поверхню, по якій молекули рідини
контактують з нечисленними молекулами
повітря. Дії молекул інших шарів рідини
на молекулу якогось внутрішнього шару
скомпенсовані, а на молекулу поверхневого
шару — ні. Завдяки результуючим
силам
На
межі з повітрям рідина має вільну
поверхню, по якій молекули рідини
контактують з нечисленними молекулами
повітря. Дії молекул інших шарів рідини
на молекулу якогось внутрішнього шару
скомпенсовані, а на молекулу поверхневого
шару — ні. Завдяки результуючим
силам ![]() молекули
внутрішніх шарів тягнуть униз молекули
поверхневого шару, створюючи таким
чином поверхневий натяг.
Сила
поверхневого натягу прямо пропорційна
довжині l границі
рідини з іншою речовиною:
молекули
внутрішніх шарів тягнуть униз молекули
поверхневого шару, створюючи таким
чином поверхневий натяг.
Сила
поверхневого натягу прямо пропорційна
довжині l границі
рідини з іншою речовиною: ![]() ;
; ![]() .
Коефіцієнт
.
Коефіцієнт ![]() називають поверхневим
натягом.
Якщо границя контакту не лінійна, то
називають поверхневим
натягом.
Якщо границя контакту не лінійна, то ![]() ,
де
,
де ![]() —
поверхнева енергія, S—
площа контакту.
—
поверхнева енергія, S—
площа контакту. ![]() .
.
Змочування. Капілярні явища
Рідина,
яка відносно матеріалу даного твердого
тіла виявляється змочуючою, піднімається
у вузенькій трубці, виготовленій із
цього матеріалу (у капілярі),
утворюючи увігнутий
меніск (а).
При цьому збільшується площа контактування
рідини і твердого тіла. Поблизу зовнішніх
стінок капіляра рідина дещо піднімається
над вільною поверхнею. І навпаки,
незмочуюча рідина опускається в капілярі,
утворюючи опуклий
меніск (б),
і відходить зовні від капіляра.
 Приклади
рідин, що змочують чисте скло: вода і
гас, а незмочуючою скло рідиною є ртуть.
За рахунок сил поверхневого натягу
краплинки ртуті набувають сферичної
форми.
Висоту h підняття
(чи опускання) рідини в капілярі можна
знаходити за формулою
Приклади
рідин, що змочують чисте скло: вода і
гас, а незмочуючою скло рідиною є ртуть.
За рахунок сил поверхневого натягу
краплинки ртуті набувають сферичної
форми.
Висоту h підняття
(чи опускання) рідини в капілярі можна
знаходити за формулою ![]() ,
де r —
радіус капіляра. Капілярність дуже
важлива в живому світі (рух вологи в
ґрунті, поживних соків у рослинах) та
техніці (підйом спирту чи гасу в ґноті,
фарбування тканин і шкіри).
,
де r —
радіус капіляра. Капілярність дуже
важлива в живому світі (рух вологи в
ґрунті, поживних соків у рослинах) та
техніці (підйом спирту чи гасу в ґноті,
фарбування тканин і шкіри).
Кристалічні й аморфні тіла. Рідкі кристали
Істиннотверді тіла — це кристали. У межах усього тіла дальній порядок зберігається тільки в монокристалах (модель — маленькі кубики, складені в один величезний куб). У природі монокристали зустрічаються рідко, частіше — полікристали, які складаються з великого числа маленьких монокристалів (кристалітів, зерен), розташованих один відносно одного неупорядковано (модель полікристала — зіставний куб, що розсипався). Для монокристалів характерна анізотропія — неоднаковість більшості фізичних властивостей речовини (за винятком теплоємності й густини) в різних напрямках. Полікристали, на відміну від монокристалів, ізотропні (окремий кристаліт анізотропний, але розташування кристалітів невпорядковане). Крім істинно твердих тіл, кристалів, існують ще й аморфні тіла. Приклади: різні смоли, віск, скло, пластмаси. Аморфні тіла мають лише ближній порядок. За структурою такі речовини — рідини (дуже в’язкі). При нагріванні, на відміну від кристалічних тіл, аморфні тіла не плавляться, а поступово розм’якшуються. (Завдяки цьому розжареному склу вдається надавати потрібної форми.) Особливий клас речовин утворюють рідкі кристали — рідини з дальнім порядком, який, на відміну від твердих кристалів, спостерігається тільки в одному напрямі. Зараз відомо понад 3000 різних рідкокристалічних речовин, багато з яких біологічного походження. Приклад: мозок людини, який має складну рідкокристалічну структуру; дезоксирибонуклеїнова кислота (рідкий кристал із величезних молекул). Сфери застосування рідких кристалів: цифрова індикація; перетворення інфрачервоного випромінювання на видиме; виготовлення плоских екранів моніторів; термоіндикація; ультразвукова медична діагностика.
Механічні властивості матеріалів. Види деформацій
Під
дією зовнішніх сил тверді тіла змінюють
свою форму і розміри — деформуються.
Поведінку тіла в процесі його деформування
зручно ілюструвати діаграмою розтягу,
зображеною на рисунку.
 Уздовж
осі ординат відкладають механічне
напруження s. Розрізняють внутрішні
напруження в тілі (
Уздовж
осі ординат відкладають механічне
напруження s. Розрізняють внутрішні
напруження в тілі ( ,
де S0
— початкова площа поперечного перерізу
тіла) і зовнішні напруження (або питоме
навантаження, розглядаються зовнішні
сили.
Уздовж осі абсцис відкладають
відносне видовження
,
де S0
— початкова площа поперечного перерізу
тіла) і зовнішні напруження (або питоме
навантаження, розглядаються зовнішні
сили.
Уздовж осі абсцис відкладають
відносне видовження ![]() ,
де l0
— початкова довжина тіла, ?l —
абсолютне видовження (?l =l – l0).
Якщо зовнішня дія була порівняно
невеликою, то її усунення супроводжується
пружним відновленням початкового стану
тіла (на діаграмі розтягу ділянка 0—1).
При зростанні навантаження більшість
матеріалів виявляє пластичні властивості
(спочатку це ділянка 1—2, потім деформація
зростає без збільшення зовнішньої сили
— матеріал пластично «тече», ділянка
2—3). Після вичерпання пластичних ресурсів
напруження зростає (ділянка 3—4), що
закінчується руйнуванням тіла (точка
4). Більшість сталей, а також сплавів на
основі міді пластичні. Однак є й крихкі
матеріали (більшість чавунів, склоподібні
матеріали).
Значення напружень, які
відповідають завершенню пружної
деформації —
зникає, після того, як дія зовнішніх сил
припиняється; початку і завершенню пластичної
деформації —
не зникає після припинення дії сил, які
їх викликали і призводять до незворотних
змін у кристалічній ґратці твердого
тіла (плинності) та зруйнуванню матеріалу
(
,
де l0
— початкова довжина тіла, ?l —
абсолютне видовження (?l =l – l0).
Якщо зовнішня дія була порівняно
невеликою, то її усунення супроводжується
пружним відновленням початкового стану
тіла (на діаграмі розтягу ділянка 0—1).
При зростанні навантаження більшість
матеріалів виявляє пластичні властивості
(спочатку це ділянка 1—2, потім деформація
зростає без збільшення зовнішньої сили
— матеріал пластично «тече», ділянка
2—3). Після вичерпання пластичних ресурсів
напруження зростає (ділянка 3—4), що
закінчується руйнуванням тіла (точка
4). Більшість сталей, а також сплавів на
основі міді пластичні. Однак є й крихкі
матеріали (більшість чавунів, склоподібні
матеріали).
Значення напружень, які
відповідають завершенню пружної
деформації —
зникає, після того, як дія зовнішніх сил
припиняється; початку і завершенню пластичної
деформації —
не зникає після припинення дії сил, які
їх викликали і призводять до незворотних
змін у кристалічній ґратці твердого
тіла (плинності) та зруйнуванню матеріалу
(![]() ,
, ![]() і
і ![]() ),
мають назву границь
(меж) пружності, плинності та міцності.
Деформації
в тілах можуть спричинятися шляхом
одновісного розтягу чи стиску; всебічного
стиску (наприклад, у рідині під поршнем);
зсуву (у чистому вигляді чи крученням).
),
мають назву границь
(меж) пружності, плинності та міцності.
Деформації
в тілах можуть спричинятися шляхом
одновісного розтягу чи стиску; всебічного
стиску (наприклад, у рідині під поршнем);
зсуву (у чистому вигляді чи крученням).
1.Основні положення мкт та їх дослідне обґрунтування. Маса і розмір молекул. Стала Авогадро. Швидкість теплового руху молекул. Дослід Штерна.
Молекулярно-кинетична теорія (МКТ) пояснює теплові явища в тілах (у речовині) та їх внутрішні властивості. Вона пов`язує закономірності поведінки окремих молекул з характеристиками властивостей тіл. Основні положення МКТ 1. Речовина складається з величезного числа дрібних частинок – молекул( атомів або іонів). 2. Ці частинки знаходяться у безперервному хаотичному русі. 3. Ці частинки (як правило) взаємодіють між собою. Атом – найдрібніша частинка хімічного елемента, що зберігає його хімічні властивості. Молекула – об єднання з кількох атомів – найдрібніша частинка речовини, що зберігає її хімічні властивості. Більшість речовин молекулярної будови (кисень, вода, аміак, метан), але є й атомарні речовини (грфіт, алмаз, гелій,і всі інертні гази), і навіть іонні речовини (всі мітали). Маючи на увазі існування атомарних та іонних речовин, усе ж умовно можна говорити узагальнено про молекулярну будову речовини. Підтвердження положень МКТ:
1)Броунівський рух.
2)Дифузія.

Ботанік Броун, розглядаючи під мікроскопом краплю рідини з урівноваженими в ній частинками (пилком), спостеріг їхній безладний рух. Частинки пилку рухаються під ударами невидимих у мікроскоп молекул.
Дифузія – це проникнення молекул деякої речовини в ділянки простору, в яких перебувають молекули іншої речовини, і навпаки (взаємна дифузія).
Маса і розміри молекул
Для кількісної оцінки речовини користуються поняттям моля – одиниці кількості речовини. Моль – це така кількість речовини, в якій міститься стільки молекул (атомів чи іонів), скільки міститься атомів в 0,012 кг вуглецю 12С. Число молів Файл:142.png де т – маса речовини, М –маса моля (визначається За таблицею Менделєєва, наприклад, МN2 = 0,028 кг/моль). Авогадро встановив: 1.Число молекул у молі: NA = 6,02 . 1023 моль-1(стала Авогадро). 2.Об єм моля будь-якого газу при нормальних тиску і темперетурі:
VM0 = 22,4 л/моль = 0,0224 м3/моль.
Маса
однієї молекули:

Число
молекул у тілі: N = γNA = (m/M)NA . Для оцінки
розміру деякої молекули можна розглядати
її як маленьку кульку, тоді її об єм (з
геометрії) дорівнює 4/3πr3. З формули
густини речовини (ρ = m/V) маємо V = m/ρ. Для
однієї молекули V 0 = т0/ρ = М/(ρNA) = 4/3 πr3.
Звідси для молекули води:

Молекули настільки малі, що за допомогою оптичних мікроскопів їх побачити не можна.
Швидкість теплового руху молекул. Дослід Штерна.

Швидкість
молекул визначають наступним чином: в
циліндрі 1 з вертикальною щілиною 2, з
якого видалено повітря, знаходиться
вольфрамова нитка розжарювання, покрита,
наприклад, сріблом. Циліндр 1 знаходиться
в циліндрі 3, з якого також відкачано
повітря. Якщо через вольфрамову нитку
пропустити струм, то при її нагріванні
срібло буде випаровуватися, причому
частина молекул срібла буде проходити
через щілину 2 циліндра 1 та потрапляти
на внутрішню стінку циліндра 3, утворюючи
при цьому наліт з металу. Якщо цю установку
привести в рухомий стан, то можна помітити
зміщення місця нальоту метала у бік,
протилежний обертанню. Це пояснюється
тим, що поки молекули рухались від
циліндра 1 до точки М на внутрішній стіні
циліндра 3, положення точки М змістилося
на відрізок МL. Знаючи місто від щілини
до точки М та відстань зміщення МL, число
обертів установки п і радіус зовнішнього
циліндру, можна обчислитишвидкість
молекул при температурі накалу нитки.
Цей дослід має назву дослід Штерна. Чим
більша швидкість молекул срібла, тим
на більшу відстань вони зміщуються.
Формула для підрахунку швидкості :
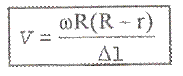
Швидкості молекул:

