
- •Электрохимические методы анализа
- •Теоретические основы электрохимичесих методов анализа
- •Электрохимические системы
- •Типы электродов, используемых в электрохимических методах анализа
- •Классификация обратимых электродов
- •Потенциометрия
- •Основы метода
- •Типы электродов
- •Потенциометрические измерения
- •Кривые титрования.
- •Способы нахождения конечной точки титрования
- •Вольтамперометрия
- •Явления на электродах электрохимической ячейки при прохождении постоянного электрического тока
- •Электродная поляризация
- •Основы метода
- •I пред. Дифф
- •Градуировка оборудования
- •Амперометрическое титрование
- •Кулонометрия
- •Теоретические основы метода. Электролиз
- •Кулонометрический анализ
- •Кулонометрическое титрование.
- •Кондуктометрия
- •Электрическая проводимость растворов электролитов.
- •Прямой кондуктометрический анализ и кондуктометрическое титрование
-
Кривые титрования.
В процессе потенциометрического титрования концентрация реагирующих веществ или ионов все время изменяется, что влечет за собой изменение равновесного потенциала электрода. Если измерить его потенциал для различных моментов титрования и построить график в координатах - V, где V - объем добавленного рабочего раствора, то получится кривая титрования с резким скачком потенциала электрода в точке эквивалентности.
Кислотно-основное титрование (Метод нейтрализации). Титрование сильных и слабых кислот сильными и слабыми основаниями (или наоборот) связано с изменением концентрации ионов Н+ в растворе, поэтому индикаторным электродом наиболее часто служит стеклянный, а электродом сравнения - обычно каломельный или хлоридсеребряный.
Пример 1. Гальванический элемент, состоящий из стеклянного электрода, селективного относительно ионов Н+, и хлоридсеребряного электрода сравнения:
Ag, AgCl|0.1 M HCl|стекло || HCl || KCl, AgC|Ag
стеклянный электрод │раствор│ хлоридсеребряный электрод
В этом случае ЭДС определяется уравнением
Е = стекл - AgCl,/Ag.
Потенциал хлоридсеребряного электрода - величина постоянная, равная 0.1988 при 250С. Следовательно, изменение ЭДС элемента определяется изменением величины потенциала стеклянного электрода, которая обусловлена обменом ионов щелочных металлов, находящихся в стекле, с ионами водорода из раствора.
При титровании раствора HCl водным раствором NaOH концентрация ионов Н+ в растворе будет уменьшаться. Это повлечет за собой изменение стекл и, соответственно, ЭДС E элемента, что будет зафиксировано прибором. Как известно, рН = - lg a(H+). Поэтому в процессе титрования концентрация Н+ уменьшается, а рН увеличивается. В зависимости от градуировки шкалы прибора за ходом титрования можно следить либо по изменению ЭДС элемента (сплошная кривая I), либо по изменению рН исследуемого раствора (пунктирная кривая 2).
A
2
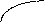
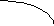


1
V,
мл Vэкв
Рис. Потенциометрические кривые основно-кислотного титрования
По кривой потенциометрического титрования определяется эквивалентная точка, которая используется для расчета концентрации определяемого вещества
N1V1 = N2V2,
где N1 - определяемая эквивалентная концентрация вещества в растворе, экв/л;
V1 - объем пробы исследуемого раствора, л;
N2 - концентрация титранта,
V2 - эквивалентный объем титранта.
При титровании сильной кислоты сильным основанием (или наоборот) происходит уменьшение концентрации ионов Н+, что приводит к уменьшению потенциала стеклянного электрода и регистрируется прибором как изменение ЭДС. В результате получается типичная кривая потенциометрического титрования. Сложнее обстоит дело при титровании слабых кислот и оснований, особенно в том случае, когда титрант тоже является слабым основанием, либо слабой кислотой. Слабые кислоты и основания в растворе диссоциируют не полностью, поэтому концентрация Н+ в растворе заметно меньше, а в процессе титрования может образовываться буферная смесь, например, слабой кислоты и ее соли. Все это приводит к тому, что при титровании слабых кислот или оснований получается потенциометрическая кривая с небольшим скачком потенциала в точке эквивалентности. Чем больше константа диссоциации, тем выше концентрация ионов в растворе и больше скачек потенциала.
Поскольку ход кривой потенциометрического титрования зависит от константы диссоциации, то можно титровать смесь кислот, отличающихся значениями KD. В этом случае на кривой потенциометрического титрования обнаруживаются два скачка потенциала: сначала оттитровывается сильная кислота (эквивалентная тока V1), а затем - слабая (V2).
Титрование в неводных растворах. Применение неводных растворителей дает возможность проводить потенциометрическое титрование таких веществ, титрование которых в водном растворе осуществляется с трудом или вообще невозможно. Например, веществ, не растворимых в воде или образующих стойкие эмульсии и суспензии, смесей кислот или оснований, которые не титруются раздельно в водном растворе.
Осаждение. Сущность способа заключается в следующем: к исследуемому раствору добавляется такой титрант, который дает с определяемыми ионами малорастворимое соединение, выпадающее в осадок. Поэтому необходимо подобрать такой индикаторный электрод, который обменивается с электролитом осаждаемыми ионами.
Пример 2. Определение Ag+ в растворе AgNO3 при титровании соляной кислотой HCl. Индикаторный электрод - серебряная проволока, электрод сравнения - каломельный.
Ag+ + Cl- = AgCl ПРAgCl = 1.7∙10-10.
E = φ Ag+/Ag - φ Hg2Cl2/Hg.
φ Hg2Cl2/Hg - величина постоянная, поэтому ЭДС определяется значением φ Ag+/Ag, который зависит от изменения активности ионов Ag+ в растворе.
φ Ag+/Ag = φ0 + (RT/nF)ln a(Ag+)/a(Ag);
В процессе титрования концентрация катионов Ag+ в исследуемом растворе уменьшается, что повлечет за собой уменьшение ЭДС. В точке эквивалентности происходит скачек, который тем больше, чем меньше величина ПР слаборастворимой соли и больше концентрация исходного раствора.
Помехи: явления адсорбции, изменение ПР осадка в присутствии посторонних электролитов.
Переведение в малодиссоциированные комплексы. Сущность способа: при добавлении титранта к исследуемому раствору количество определяемых ионов уменьшается, так как они связываются в малодиссоциированный комплекс.
Пример 3. Титрование цианид-ионов раствором нитрата серебра (обратимая реакция, равновесие которой определяется константой нестойкости комплексного иона).
Ag+ + 2CN- = [Ag(CN)2]-, Kн = [Ag+][CN-]2/[Ag(CN)2- ] = 1.0∙10-21.
В процессе титрования концентрация свободных ионов серебра в растворе меняется, потенциал серебряного электрода возрастает и ЭДС увеличивается. В точке эквивалентности обнаруживается резкий скачек потенциала. При дальнейшем титровании на кривой возникает почти горизонтальный участок, так как последующее добавление нитрата серебра ведет к образованию в растворе осадка
[Ag(CN)2]- +Ag+ = 2AgCN.
Концентрация ионов серебра в растворе, от которой зависит величина потенциала индикаторного электрода, определяется растворимостью образующегося осадка. До тех пор, пока весь комплекс не превратится в осадок, потенциал системы остается практически постоянным.
Скачек потенциала в точке эквивалентности тем больше, чем меньше константа диссоциации комплекса и чем больше концентрация титруемого раствора.
Помехи: При использовании большинства органических комплексообразователей процесс титрования сильно зависит от рН раствора, так как при различных рН образуются комплексы с различной константой нестойкости и различного состава.
Окислительно-восстановительное титрование. При протекании окислительно-восстановительных реакций в растворе присутствуют ионы в окисленной и восстановленной формах. Если подобрать индикаторный электрод, обратимый относительно этих ионов, то в процессе титрования будет меняться величина электродного потенциала и, следовательно, ЭДС гальванического элемента.
Пример 4. Титрование хлорида железа (III) раствором хлорида олова (II):
2Fe3+ + Sn2+ = 2Fe2+ + Sn4+.
Электродные полуреакции и их стандартные потенциалы:
2Fe3+ + 2e = 2Fe2+, φ0 = + 0.77 B
Sn2+ - 2e = Sn4+, φ0 = + 0.15 B
В качестве индикаторного электрода можно использовать платину, а электрода сравнения - каломельный электрод, помещенный в раствор хлорида железа. Потенциал платинового электрода в растворе хлорида железа (III) описывается уравнением
φ Fe3+/Fe2+ = φ0 Fe3+/Fe2+ + (RT/nF)ln ([Fe3+]/[Fe2+])
E = φ Fe3+/Fe2+ - φ Hg2Cl2/ Hg, = (φ0 Fe3+/Fe2+ - φ0 Hg2Cl2/ Hg) + (RT/nF)ln [Fe3+]/[Fe2+]
Изменение концентрации ионов Fe3+/Fe2+ в растворе в процессе титрования повлечет за собой изменение величины потенциала индикаторного электрода, которое зафиксируется измерительным электродом. В точке эквивалентности последует скачек потенциала, после чего потенциал электрода будет определяться системой Sn4+/Sn2+. Скачек потенциала будет тем больше, чем больше разность стандартных окислительно-восстановительных потенциалов и концентрация титруемого раствора и титранта.
