
- •Химическая связь
- •Взаимное влияние атомов в органических молекулах
- •Пространственное строение органических молекул
- •Физико-химические методы идентификации
- •Общие закономерности реакционной способности органических соединений
- •Реакционная способность насыщенных углеводородов
- •Непредельные углеводороды
- •Ароматические углеводороды Арены
- •Галогенпроиводные углеводороды
- •Гидроксопроизводные углеводороды
- •Простые эфиры
- •Оксосоединения
- •Овр карбонильныхсоединений
- •Карбоновые кислоты
- •Функциональные производные карбновых кислот
- •Ароматические карбоновые кислоты
Оксосоединения
Содержат в своем составе оксо-группу ( – С=О).
- альдегиды: - кетоны:
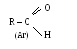
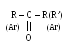
Номенклатура:
Альдегиды:
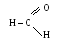 Суффикс
-аль- (метаналь, формальдегид, муравьиный
альдегид)
Суффикс
-аль- (метаналь, формальдегид, муравьиный
альдегид)
 (этаналь, ацетальдегид, уксусный
альдегид)
(этаналь, ацетальдегид, уксусный
альдегид)
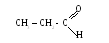 (пропаналь)
(пропаналь)
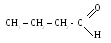 ( масляный альдегид)
( масляный альдегид)
-
Валериановый;
-
Капроновые.
Кетоны:
 пропанон, ацетон, диметилкетон
пропанон, ацетон, диметилкетон
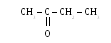 бутанон,
метилэтилкетон
бутанон,
метилэтилкетон
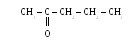 пентанон-2,
метилпропилкетон
пентанон-2,
метилпропилкетон
Физические свойства: Молекулы альдегидов и кетонов имеют более низкие температуры кипения, чем спирты с тем же числом атомов С, т.к. в них отсутствуют водородные связи.
Способы получения:
- Окисление спиртов: первичные – до альдегидов, вторичные – до кетонов;
- Дегидрирование спиртов;
- Восстановление хлорангидридов кислот

- По реакции Кучерова (гидратация алкенов);
- Пиролиз солей карбоновых кислот с двухвалентными металлами;

- Озонолиз алкенов;
- Оксосинтез
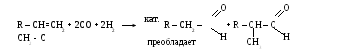
- Гидролиз геминальных дигалогенпроизводных
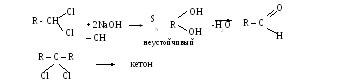
Ароматизированные кетоны получаются ацилированием аренов по Фриделю – Крафтсу.

Строение оксо-групы:


С δ+=Оδ-
δ+=Оδ-
Атом С, находится в sp2 – гибридизации.(угол в 120°)
С=С (120°) π-связь неполяризована, l=0,134 нм, Е=620кДж/моль
Характерны реакции электрофильного присоединения
π-связь смещена в сторону более электроотрицательного атома О, поляризована l=0,121 нм Е=750кДж/моль
Характерно нуклеофильно присоединение
С = О
↑ ↑
Nu E
Механизм реакции:

Атака атома С равновероятна с обеих сторон, поэтому в результате реакци образуется рацемат.
Альдегиды более реакционноспособны, чем кетоны, т.к.:
- реакционная способность в реакци AN зависит от величины δ+(частично положительного заряда на карбонильном атоме С)
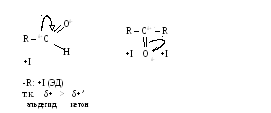
- Пространственая доступность
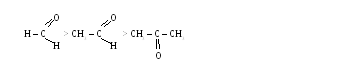
С повышением числа радикалов, связанных с карбонильной группой повышается пространственная затрудненность для нуклеофильной атаки.
- кислотно-основные свойства среды
Характерные реакции:
-
Реакции с кислородсодержащими нуклеофилами
Гидратация
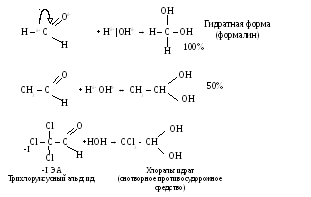
Ацетат хорошо рстворяется в воде, но вновь с ней не реагирует.
Присоединение спиртов
При присоединении 1 моль спирта к альдегиду образуется полуацеталь, а от двух молей – ацеталь. Соответственно у кетонов – полукетали и кетали. Реакция обратима и требует кислотного катализа.
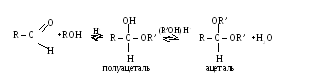
Механизм:
Т.к. спирты являются слабыми нуклеофилами, необходимо катализатора роль которого заключается в привлечении электрофильности карбонильного атома С.

Превращение полуацеталя в ацеталь также происходит в присутствии катализатора, который необходим для превращения плохо уходящей – ОН группы в хорошо уходящую воду.
 Полуацетали
и ацетали легко гидролизуются в кислотной
среде, но устойчивы в щелочной.
Полуацетали
и ацетали легко гидролизуются в кислотной
среде, но устойчивы в щелочной.
При наличии в молекуле одновременно карбонльных и гидроксильных групп, разделенных тремя или четырьмя атомами С реакция идет внутримолекулярно.
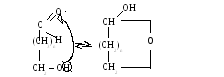
-
Реакция присоединения с серосодержащими нуклеофилами.
Присоединение гидросульфита Na
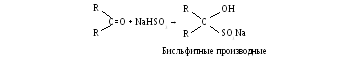
Это кристаллические вещества. Они могут быть легко регенерированы в исходные карбоновые соединения при обработке кислотой или щелочью
Реакция с тиолами

-
Реакция с углеводородами, содержащими Nu.
Присоединение улановодорода(синильная кислота)

Основание необходимо для получения необходимого нуклеофила из слабой кислоты HCN.
Механизм:
HCN + OH- → CN- + H2O
Основание как катализатор

-
Присоединение металлоорганических соединений.
а)
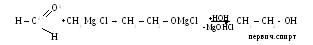
б)
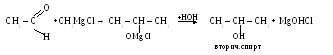
в)
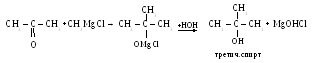
-
Реакции с участием CH кислотного центра.
Карбонильная группа, проявляя - I, оказывает влияние на подвижность водородов у соседних атомов С. В результате молекула может существовать в двух изомерных формах: в оксо-форме и в енольной форме.
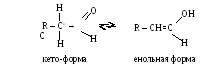
Простейшие альдегиды и кетоны существуют в кето-форме.
Альдольная конденсация:
Под действием каталитичских количеств кислоты или основания альдегиды
превращаются в этооксиальдегид.

Карбонильная компонента: реакционным центром является альдегидная группа.
Метиленовая компонента: реакционным центром является СН – кислотный центр, у которого под действием оснований возможно отщепление протона.
Механизм реакции:
Под действием оснований происходит отрыв протона от α-углеродного атома с образоваием карбоаниона, который стаблизируется за счет делокации заряда.

В альдольную конденсацию вступают лишь те карбонильные соединения, которые имеют у α-углеродного атома подвижные атомы Н.
По типу альдольных конденсаций происходит биосинтез лимонной кислоты в организме.

Протоновая конденсация:
В более жестких условиях альдоли отщепляют молекулу H2O, обазуя α,β – ненасыщенные альдегиды
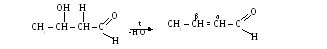
Дегидратация идет легко по двум причинам:
-
У α-углеродных атомов имеются «кислые» атомы Н;
-
В полученном непредельном альдегиде содержится сопряженная система двойных связей, что приводит к стабилизации молекулы.
Конденсация альдегида с ангидридами карбоновых кислот:

Конденсация с сильными CH кислотами:
Реакция Клевенапеля:
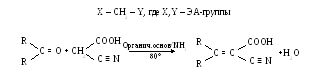
-
Реакции с азотсодержащими нуклеофилами (Реакции присоединения - отщепления)
Реакция в общем виде сводится к конденсации карбонильных групп с реагентами типа H2N – X.
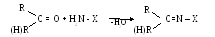
- взаимодействие с аминами:

Механизм реакции:

Соединение неустойчиво:
- С карбонильным атомом С связаны одновременно две элеткроно – акцепторные группы;
- У атома N имеются еще один «кислый» атом Н
С аммиаком образуются незамещенные амины, которые неустойчивы.
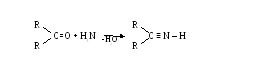
Полученные соединения представляют собой твердые вещества с четными температурами плавления, поэтому их используют как идентификаторы.
Продукты конденсаци можно легко гидролизовать до исходных карбоновых соединений, что позволяет применять эти реакции для выделения альдегидов кетонов из смеси
Галоформные реакции:
Позволяют получить галоформы: хлороформ, бромоформ, йодоформ.
Эта реакция также связана с пдвижностью атома Н у α – углеродного атома, и в нее вступают карбонильные соединения, содержащие фрагмент, а также и спирты, которые в суловиях этой реакции окисляются до карбонильных соединений, содержащих этот фрагмент.

Ход реакции:
I2 + NaOH→NaI + NaOI

Полимеризация альдегидов:
Простейшие альдегиды могут образовывать линейные или циклические полимеры.
nCH2O + H2O→H – (CH2O) n – OH (белый осадок)
Параформ образуется при длительном хранении формалина при низких температурах. При нагревании происходит деполимеризация.
Циклические тримеры образуются в кислотных средах.

Реакции замещения карбонильного кислорода на галогены:
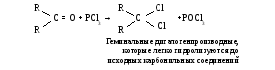
Реакции с элидами фосфора(реакции Виттига):

