
- •1. Моделі атома Томпсона та Резерфорда. Позитивна сторона моделей і їх недоліки.
- •2.Спектр атома водню. Узагальнена формула Больцмана
- •3. Постулати Бота. Спектр атома водню по Бору
- •4. Гіпотеза Луї де Бройля. Корпускулярно-хвильовий дуалізм матерії;
- •5. Розмір, склад та заряд атомного ядра. Масове та зарядове число
- •6. Дефект маси та енергія зв’язку ядра. Питома енергія зв’язку
- •7 Ядерні сили. Властивості ядерних сил
- •8 Радіоактивне випромінювання та його типи
- •9 Закон Радіоактивного розпаду. Активність нукліда. Правило зміщення
- •10 Гама випромінювання та його властивості
- •11 Ядерні реакції та їх класифікація
- •12 Реакції поділу ядер. Ланцюгові реакції. Поняття про ядерну енергетику
2.Спектр атома водню. Узагальнена формула Больцмана
Дослідження спектрів випромінювання розріджених газів (тобто спектрів випромінювання окремих атомів) показали, що кожному газу властивий певний лінійчастий спектр, який складається з окремих спектральних ліній. Найбільш вивченим є спектр атома водню.
Швейцарський вчений І. Бальмер у 1885 р. встановив, що довжини хвиль відомих на той час дев’яти ліній спектра атома водню можна обчислити за формулою:
![]() ,
,
де
![]() ,
,
![]() .
.
Цю формулу записують в іншому вигляді:
![]() ,
,
![]()
де
![]() ,
,
![]() –
стала Рідберга.
–
стала Рідберга.
Оскільки
![]() ,
то
,
то
![]() ,
,
де
![]() ,
яку також називають сталою Рідберга.
,
яку також називають сталою Рідберга.
Спектральні
лінії, що відрізняються різними значеннями
n,
утворюють серію ліній, яка називається
серією Бальмера. Із збільшенням n
лінії серії зближуються; значення
![]() визначає
границю серії, до якої з боку більших
частот прилягає суцільний спектр:
визначає
границю серії, до якої з боку більших
частот прилягає суцільний спектр:
![]() .
Крім того, виявляється, що зі збільшенням
номера лінії її інтенсивність зменшується.
.
Крім того, виявляється, що зі збільшенням
номера лінії її інтенсивність зменшується.
На початку ХХ ст. у спектрі водню було виявлено ще декілька серій спектра випромінювання, які знаходяться у невидимій ділянці.
В ультрафіолетовій ділянці –
серія
Лаймана:
![]() ,
(
,
(![]() );
);
в інфрачервоній області ділянці –
серія
Пашена:
![]() ,
,
(![]() );
);
серія
Брекета:
![]() ,
,
(![]() );
);
серія
Пфунда:
![]() ,
,
(![]() );
);
серія
Хемфрі:
![]() ,
,
(![]() ).
).
Всі серії у спектрі водню можуть бути описані однією формулою, яка називається узагальненою формулою Бальмера:
![]() ,
,
де
![]() і
визначає серію, а
і
визначає серію, а
![]() і
визначає окремі лінії серії.
і
визначає окремі лінії серії.
3. Постулати Бота. Спектр атома водню по Бору
Перша спроба побудови якісно нової теорії атома була зроблена в 1913 р. Н. Бором. Він поставив перед собою мету зв’язати в єдине ціле емпіричні закономірності лінійчастих спектрів, ядерну модель атома Резерфорда і квантовий характер випромінювання та поглинання світла.
Теорія
Бора застосовна до атома водню і
воднеподібної системи, яка складається
із ядра з зарядом
![]() і
одного електрона, що обертається навколо
ядра:
і
одного електрона, що обертається навколо
ядра:
![]() ,
,
![]() ,….
,….
В основу своєї теорії Бор поклав три постулати.
Перший
постулат Бора (постулат стаціонарних
станів):
існують деякі стаціонарні стани атома
з відповідними значеннями енергії
![]() перебуваючи
в яких, він не випромінює енергії.
перебуваючи
в яких, він не випромінює енергії.
Цим стаціонарним станам відповідають цілком визначені (стаціонарні) орбіти, по яких рухаються електрони, які, незважаючи на наявність у них прискорення, електромагнітних хвиль не випромінюють.
Другий постулат Бора (правило квантування орбіт): в стаціонарному стані атома електрон, рухаючись по коловій орбіті, повинен мати квантові значення моменту імпульсу, які задовольняють умову
![]() ,
,
де
![]() –
маса електрона,
–
маса електрона,
![]() –
його швидкість,
–
його швидкість,
![]() –
радіус орбіти електрона.
–
радіус орбіти електрона.
Третій
постулат Бора (правило частот):
при переході атома з одного стаціонарного
стану в інший випромінюється або
поглинається один фотон з енергією
![]() ,
яка дорівнює різниці енергій відповідних
стаціонарних станів.
,
яка дорівнює різниці енергій відповідних
стаціонарних станів.
Випромінювання
фотона відбувається при переході атома
зі стану з більшою енергією
![]() у
стан з меншою енергією
у
стан з меншою енергією
![]() ,
тобто при переході електрона з орбіти
більш віддаленої від ядра на ближчу до
ядра орбіту. Поглинання енергії
супроводжується переходом атома у стан
з більшою енергією, і електрон переходить
на віддаленішу від ядра орбіту. Набір
можливих частот
,
тобто при переході електрона з орбіти
більш віддаленої від ядра на ближчу до
ядра орбіту. Поглинання енергії
супроводжується переходом атома у стан
з більшою енергією, і електрон переходить
на віддаленішу від ядра орбіту. Набір
можливих частот
![]() квантових
переходів і визначає лінійчастий спектр
атома.
квантових
переходів і визначає лінійчастий спектр
атома.
Постулати, висунуті Бором, дозволили розрахувати спектр атома водню і воднеподібних систем, а також теоретично розрахувати сталу Рідберга.
Враховуючи припущення Резерфорда, що електрон у воднеподібній системі рухається по коловій орбіті радіусом r під дією кулонівської сили притягання електрона до ядра, яка створює доцентрове прискорення, запишемо:
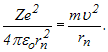
Підставивши
сюда величину
![]() з
виразу
з
виразу
![]() ,
отримаємо:
,
отримаємо:
 і
і
![]() ,
,
де
![]()
Радіуси орбіт зростають пропорційно квадратам цілих чисел.
Енергія електрона у воднеподібній системі дорівнює сумі його кінетичної і потенціальної енергій в електростатичному полі ядра:
 .
.
Знак “–“ означає, що електрон знаходиться у зв’язаному стані.
Енергетичні стани атома утворюють послідовність енергетичних рівнів, що змінюються залежно від значення n, яке виражає номер енергетичного рівня атома.
Надаючи n різні цілочислові значення, отримаємо для атома водню (Z = 1) можливі рівні енергії (рис. 168).
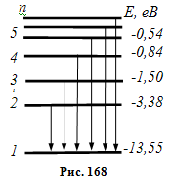
Енергія
атома водню із збільшенням n
зростає (зменшується її від’ємна
величина), і енергетичні рівні наближаються
до границі, що відповідає значенню
![]() .
Атом водню має мінімальну енергію
.
Атом водню має мінімальну енергію
![]() при
n=1
і максимальну
при
n=1
і максимальну
![]() при
при
![]() .
.
Згідно з третім постулатом Бора
 ,
,
звідки частота випромінювання
![]() ,
,
де
 .
Значення
.
Значення
![]() .
Це підтверджує правильність отриманої
Бором формули для енергетичних рівнів
водневоподібної системи.
.
Це підтверджує правильність отриманої
Бором формули для енергетичних рівнів
водневоподібної системи.
Теорія Бора не позбавлена внутрішніх протиріч (з одного боку, застосовує закони класичної фізики, з іншого, – ґрунтується на квантових постулатах). Вона змогла пояснити спектри водню і водневоподібних систем і обчислити частоти спектральних ліній, але не змогла пояснити їх інтенсивність і не дала відповіді на запитання: чому здійснюються ті чи інші переходи? У теорії Бора не описано атом гелію – один з простих атомів, що безпосередньо слідує за атомом водню.
