
- •1. Основные понятия теории растворов электролитов
- •2. Теория с Аррениуса/
- •3. Равновесие электролитической диссоциации в растворе
- •4. Ионное произведение воды
- •5. Водородный показатель. Расчет рН растворов кислот и оснований
- •1. Классификация кислотно-основных буферных систем:
- •Механизм действия буферных систем и расчетные формулы для определения рН в этих растворах
- •Вычисление рН буферных растворов Уравнение Гендерсона -Хассельбаха
- •2. Отсюда находим:
- •4. Буферная емкость. Факторы, определяющие буферную емкость
Лекция Растворы электролитов и ионные равновесия
1. Основные понятия теории растворов электролитов
Электролитами называют вещества, при взаимодействии с растворителем подвергающиеся диссоциации на ионы и сообщающие раствору способность проводить электрический ток.
Различают слабые и сильные электролиты. Сильные электролиты в растворе полностью распадаются на ионы. К таким электролитам относятся сильные кислоты и основания, а также соли.
Слабые электролиты в растворе распадаются на ионы частично. К слабым электролитам относятся карбоновые кислоты, аммиак, амины, фенолы и др.
Количество ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона электронейтральности, в соответствии с которым сумма положительных зарядов должна быть равна сумме отрицательных. Например, СаCI2→Ca2++2CI-.
Электролиты, молекулы которых распадаются на два иона, называются бинарными или симметричными. Если при этом образуются однозарядные ионы, электролит относится к типу 1, 1-валентных (NaCl и т.д.), если двухзарядные — к типу 2, 2-валентных (MgSO4 и т.д.). Для несимметричных электролитов (K2SO4 и т.д.) тип электролита также устанавливается по заряду ионов и относится к типу 1,2.
2. Теория с Аррениуса/
Согласно теории С. Аррениуса (1883—1887), процесс распада растворенного вещества на ионы называют электролитической диссоциацией. Распад на ионы происходит независимо от того, подвергается или не подвергается вещество действию электрического тока.
Способность электролитов распадаться на ионы количественно оценивают степенью диссоциации (а).
Степенью электролитической диссоциации называют отношение числа молекул распавшихся на ионы пi, к исходному числу молекул пΣ:

Для сильных электролитов а = 1, а для слабых много меньше единицы. Степень диссоциации слабых электролитов зависит от концентрации электролита в растворе.
3. Равновесие электролитической диссоциации в растворе
Диссоциация слабых электролитов подчиняется закону действующих масс и может быть количественно охарактеризована константой равновесия (при постоянных условиях не изменяющиеся во времени).
Например, в системе вода– уксусная кислота устанавливается равновесие:
CH3COOH↔H++CH3COO-
Число молекул, распавшихся в единицу времени, равно числу молекул, образовавшихся за счет соединения ионов Н+ и CH3COO-.
Константа равновесия реакции диссоциации – это есть константа диссоциации (Кд). Например, выражение для Кд уксусной кислоты имеет вид:
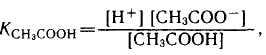 (1)
(1)
где [Н +] и [CH3COO-] —равновесные концентрации соответствующих ионов, моль/л; [СНзСООН] — равновесная концентрация недиссоциированных молекул кислоты, моль/л.
Константы диссоциации, выражаемые уравнениями (1), называют классическими (или концентрационными) константами и обозначают Кс (в отличие от термодинамических констант, которые обозначают Ка).

Как видно, степень диссоциации возрастает обратно пропорционально корню квадратному из концентрации электролита. Например, при уменьшении концентрации в 100 раз степень диссоциации возрастает в 10 раз.
Таким образом, степень диссоциации электролита зависит:
-
от концентрации,
-
от природы растворителя,
-
электролита и температуры.
Аналогично, в системе Н2О — NH4OH устанавливается равновесие:


.
Для
расчетов, связанных с диссоциацией
кислот, часто
удобно пользоваться не константой Кс,
а
так называемым
показателем
константы диссоциации рК,
который
определяется соотношением:![]()
Очевидно, что с возрастанием К, т. е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислоты.
В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Так, диссоциация ортофосфорной кислоты протекает в три ступени:

каждой из которых отвечает определенное значение ступенчатой константы диссоциации. Поскольку К1>K2> Кз, то в наибольшей степени протекает диссоциация по первой ступени, а при переходе к каждой последующей стадии степень диссоциации, как правило, резко уменьшается.
